题目内容
【题目】![]() (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取
(连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取![]() 的方法很多,
的方法很多,
(1)在碱性溶液中用![]() 还原
还原![]() 法制备
法制备![]() 的反应原理为:
的反应原理为:![]() (未配平)反应装置如图所示:
(未配平)反应装置如图所示:
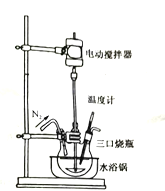
①实验开始及整个过程中均需通入![]() ,其目的是__________________________________。
,其目的是__________________________________。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________。
③为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() ______________。
______________。
(2)用![]() 还原
还原![]() 制备
制备![]() 的装置(夹持加热仪器略)如下:
的装置(夹持加热仪器略)如下:
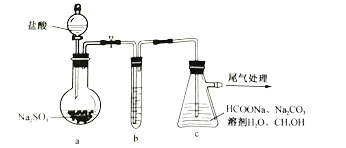
①装置a烧瓶中发生反应的化学方程式为_________________________________。
②装置b用于净化![]() ,适宜的试剂是______________________________。
,适宜的试剂是______________________________。
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,该反应的化学方程式为________________________,加入
,该反应的化学方程式为________________________,加入![]() 的目的是________________________;利用反应后的浊液分离提纯
的目的是________________________;利用反应后的浊液分离提纯![]() 需经过的操作为_____________________________________________________。
需经过的操作为_____________________________________________________。
【答案】排出装置内空气,使反应在无氧状况下进行 使反应液均匀受热 小于8:1(或<8) ![]() 饱和
饱和![]() 溶液
溶液 ![]() 降低
降低![]() 的溶解度 过滤、洗涤、重结晶、过滤、干燥
的溶解度 过滤、洗涤、重结晶、过滤、干燥
【解析】
(1)①![]() 在空气中极易被氧化,通入
在空气中极易被氧化,通入![]() 其目的是排出装置内空气;
其目的是排出装置内空气;
②采用水浴加热的主要优点是使反应液均匀受热;
③![]() ,根据得失电子守恒可知,
,根据得失电子守恒可知,![]() =8;
=8;
(2)①装置a烧瓶中发生Na2SO3与盐酸反应生成SO2的反应;
②生成的SO2气体中含有HCl气体,根据性质选择除杂溶液;
③装置c在70~83℃![]() 和
和![]() 、
、![]() 反应生成
反应生成![]() 并析出,同时逸出
并析出,同时逸出![]() ;
;![]() 不溶于甲醇,加入
不溶于甲醇,加入![]() 可降低
可降低![]() 的溶解度;利用反应后的浊液分离提纯
的溶解度;利用反应后的浊液分离提纯![]() 需重结晶。
需重结晶。
(1)①![]() 在空气中极易被氧化,实验开始及整个过程中均需通入
在空气中极易被氧化,实验开始及整个过程中均需通入![]() ,其目的是排出装置内空气,使反应在无氧状况下进行;
,其目的是排出装置内空气,使反应在无氧状况下进行;
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是使反应液均匀受热;
③根据得失电子守恒配平方程式,![]() ,
,![]() =8,为使
=8,为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() <8;
<8;
(2)①装置a烧瓶中发生反应的化学方程式为![]() ;
;
②生成的SO2气体中含有HCl气体,除杂适宜的试剂是饱和![]() 溶液;
溶液;
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,化学方程式为
,化学方程式为![]() ;
;![]() 不溶于甲醇,加入
不溶于甲醇,加入![]() 的目的是降低
的目的是降低![]() 的溶解度;利用反应后的浊液分离提纯
的溶解度;利用反应后的浊液分离提纯![]() 需经过的操作为过滤、洗涤、重结晶、过滤、干燥。
需经过的操作为过滤、洗涤、重结晶、过滤、干燥。