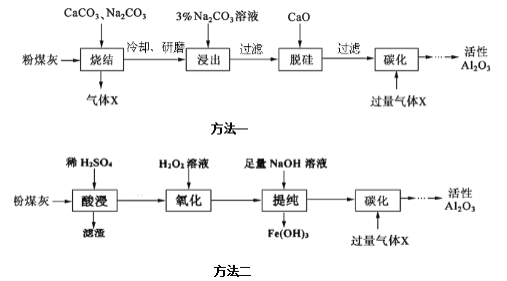
题目内容
【题目】下列装置中有机物样品在电炉中充分燃烧,通过测定生成的CO2和H2O的质量,来确定有机物分子式。
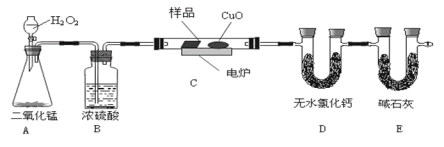
(1)A装置是提供实验所需的O2,C中CuO的作用是__。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为__。
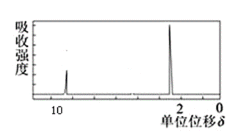
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,该化合物的结构简式是:___。
(4)若符合下列条件,则该有机物的结构简式为___。
①环状化合物
②只有一种类型的氢原子
(5)某同学认为E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是___。
【答案】使有机物充分氧化生成CO2、H2O C2H4O CH3CHO 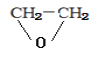 吸收空气中的二氧化碳和水蒸气
吸收空气中的二氧化碳和水蒸气
【解析】
实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O),E用来吸收二氧化碳,测定生成二氧化碳的质量,D用来吸收水,测定生成水的质量,B用于干燥通入E中的氧气、A用来制取反应所需的氧气、C是在电炉加热时用纯氧气氧化管内样品;核磁共振氢谱可以确定有机物分子中有多少种氢原子,以及不同环境氢原子的个数比。
(1)CuO具有一定氧化性,可以使有机物充分氧化生成CO2、H2O;
(2)D管增重的质量为水的质量,所以n(H2O)=![]() =0.02mol,所以有机物中n(H)=0.04mol,E管增重的质量为二氧化碳的质量,所以n(CO2)=
=0.02mol,所以有机物中n(H)=0.04mol,E管增重的质量为二氧化碳的质量,所以n(CO2)=![]() =0.02mol,所以该有机物中n(C)=0.02mol,有机物中C、H元素总质量为0.04mol×1g/mol+0.02mol×12g/mol=0.28g,所以还有0.44g-0.28g=0.16g氧原子,n(O)=
=0.02mol,所以该有机物中n(C)=0.02mol,有机物中C、H元素总质量为0.04mol×1g/mol+0.02mol×12g/mol=0.28g,所以还有0.44g-0.28g=0.16g氧原子,n(O)=![]() =0.01mol,所以有机物中n(C):n(H):n(O)=0.02:0.04:0.01=2:4:1,已知该物质的相对分子质量为44,则分子式为:C2H4O;
=0.01mol,所以有机物中n(C):n(H):n(O)=0.02:0.04:0.01=2:4:1,已知该物质的相对分子质量为44,则分子式为:C2H4O;
(3)若该有机物的核磁共振氢谱如图所示,峰面积之比为1:3,所以分子中含两种氢原子,且数量比为1:3,则其结构简式应为CH3CHO;
(4)若为环状化合物,只有一种类型的氢原子,则该有机物的结构简式为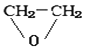 ;
;
(5)E装置直接与空气接触,可能吸收空气中的水和二氧化碳,导致测得结果不准确,所以可E后再增加一个E装置,吸收空气中的二氧化碳和水蒸气。

 名校课堂系列答案
名校课堂系列答案【题目】(Ⅰ)已知在448℃时,反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)
2HI(g)的平衡常数K1为49,则该温度下反应2HI(g)![]() H2(g)+I2(g)的平衡常数K2为___;
H2(g)+I2(g)的平衡常数K2为___;
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是___。
A.容器中压强不变 B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆 D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)C(H2)=c(CO)c(H2O),判断此时温度为___℃。