题目内容
【题目】【天津市和平区2017届第三次质量调查(三模)】A、B、C、D、E、F是分属三个短周期的主族元素,且原子序数依次增大。A、D同主族,B的氢化物水溶液呈碱性,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一。请化学用语回答下列问题:
(1)F在元素周期表中的位置为_______________。
(2)常温下,液态的B2A4与气态的BC2两者发生反应生成无毒物质,16g B2A4发生反应放热akJ,该反应的热化学方程式为_______________。
(3)D2E溶液在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。H的电子式为_______,写出在空气中长期放置生成H的化学反应方程式为:_________。H的溶液与稀硫酸反应产生的现象为_____________。
(4)化学家发现一种化学式为A4B4的离子化合物,一定条件下1mol A4B4熔融电离生成两种离子各1mol,则该物质熔融时的电离方程式为____________。
(5)向30mL某浓度由A、B、C、D中三种元素形成一元强碱溶液通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V[HCl(aq)]的关系有下列图示两种情况(不计CO2的溶解)。
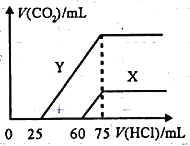
则曲线Y表明M中的溶质为________;原NaOH溶液的物质的量浓度为_______;由曲线X、Y可知,两次实验通入的CO2的体积比为_________。
【答案】 第三周期第ⅦA族 2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) △H=-4akJ/mol ![]() 4Na2S+O2+2H2O=4NaOH+2Na2S2 溶液由黄色变为无色,产生浅黄色沉淀和气体产生 NH4N3
4Na2S+O2+2H2O=4NaOH+2Na2S2 溶液由黄色变为无色,产生浅黄色沉淀和气体产生 NH4N3![]() NH4++N3- NaHCO3和Na2CO3 0.25mol/L 3:10
NH4++N3- NaHCO3和Na2CO3 0.25mol/L 3:10
【解析】本题考查元素周期律和元素周期表的推断,B的氢化物水溶液显碱性,即B为N,C、E同主族,形成的化合物EC2是形成酸雨的主要物质之一,因此EC2为SO2,E为S,C为O,属于短周期元素,原子序数依次增大,即A为H,A和D属于同主族,即D为Na,F为Cl,(1)Cl位于第三周期VIIA族;(2)B2A4是N2H4,BC2是NO2,生成无毒物质,反应方程式为2N2H4+2NO2=3N2+4H2O,燃烧1molN2H4放出的热量是32×a/16kJ=2akJ,因此热化学反应方程式为:2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) △H=-4akJ·mol-1 ;(3)D2E为Na2S,生成物之一H,与Na2O2的结构和性质相似,H为Na2S2,过氧化钠电子式为![]() ,Na2S2的电子式为:
,Na2S2的电子式为:![]() ;根据信息,生成Na2S2的反应方程式为4Na2S+O2+2H2O=4NaOH+2Na2S2,Na2S2的化学性质与Na2O2相似,与硫酸反应,可以认为发生Na2S2+2H2O=2NaOH+H2S2,H2S2分解成H2S和S,硫酸与NaOH发生中和反应,因此现象是:溶液由黄色变为无色,产生浅黄色沉淀和气体产生;(4)A4B4的化学式为H4N4,属于离子化合物,应是铵盐,即NH4N3,其熔融状态下的电离方程式为:NH4N3
;根据信息,生成Na2S2的反应方程式为4Na2S+O2+2H2O=4NaOH+2Na2S2,Na2S2的化学性质与Na2O2相似,与硫酸反应,可以认为发生Na2S2+2H2O=2NaOH+H2S2,H2S2分解成H2S和S,硫酸与NaOH发生中和反应,因此现象是:溶液由黄色变为无色,产生浅黄色沉淀和气体产生;(4)A4B4的化学式为H4N4,属于离子化合物,应是铵盐,即NH4N3,其熔融状态下的电离方程式为:NH4N3![]() NH4++N3-;(5)三种元素构成的一元强碱,此碱为NaOH,NaOH与CO2反应后溶液中的溶质,可能为NaOH、Na2CO3,Na2CO3,Na2CO3和NaHCO3,NaHCO3,碳酸钠与盐酸反应的方程式为Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,因此Y表示的M中含有的溶质为Na2CO3和NaHCO3,当加入75mL的盐酸时,气体体积达到最大,其溶液中的溶质为NaCl,根据元素守恒,n(NaOH)=n(NaCl)=n(HCl)=75×10-3×0.1mol=7.5×10-3mol,,c(NaOH)=7.5×10-3/30×10-3mol·L-1=0.25mol·L-1;X对应物质为NaOH、Na2CO3,X对应吸收CO2的物质的量为(75-60)×10-3×0.1=1.5×10-3mol,Y对应CO2的物质的量(75-25)×10-3×0.1mol=5×10-3mol,因此两者CO2的体积比值为1.5×10-3:5×10-3=3:10。
NH4++N3-;(5)三种元素构成的一元强碱,此碱为NaOH,NaOH与CO2反应后溶液中的溶质,可能为NaOH、Na2CO3,Na2CO3,Na2CO3和NaHCO3,NaHCO3,碳酸钠与盐酸反应的方程式为Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O,因此Y表示的M中含有的溶质为Na2CO3和NaHCO3,当加入75mL的盐酸时,气体体积达到最大,其溶液中的溶质为NaCl,根据元素守恒,n(NaOH)=n(NaCl)=n(HCl)=75×10-3×0.1mol=7.5×10-3mol,,c(NaOH)=7.5×10-3/30×10-3mol·L-1=0.25mol·L-1;X对应物质为NaOH、Na2CO3,X对应吸收CO2的物质的量为(75-60)×10-3×0.1=1.5×10-3mol,Y对应CO2的物质的量(75-25)×10-3×0.1mol=5×10-3mol,因此两者CO2的体积比值为1.5×10-3:5×10-3=3:10。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案