题目内容
1.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的$\frac{11}{12}$(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )| A. | 4:5:2 | B. | 4:6:2 | C. | 6:4:3 | D. | 6:2:3 |
分析 发生反应:2Na2O2+2CO2=2Na2CO3+O2,导致混合气体物质的量减小,设三者的物质的量分别为4mol,则反应后气体总物质的量为12mol×$\frac{11}{12}$=11mol,根据差量法计算反应二氧化碳物质的量、生成氧气物质的量,进而计算反应后混合气体中N2、O2、CO2物质的量之比.
解答 解:设三者的物质的量分别为4mol,则反应后气体总物质的量为12mol×$\frac{11}{12}$=11mol,
2Na2O2+2CO2=2Na2CO3+O2 物质的量减小
2 1 1
2mol 1mol 12mol-11mol=1mol
反应后混合气体中N2、O2、CO2物质的量之比=4+mol:(4+1)mol:(4-2)mol=4:5:2,
故选:A.
点评 本题考查化学方程式计算,难度不大,注意差量法的应用,侧重考查学生分析计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.1mol NaCl中的Cl-的物质的量为( )
| A. | 0.5 mol | B. | 2 mol | C. | 1 mol | D. | 0.3 mol |
9.同温同压下,分别为1mol的氢气和氧气,它们的( )
| A. | 质量相同,体积不同 | B. | 分子个数相同,质量相同 | ||
| C. | 体积相同,分子数不同 | D. | 体积相同,分子数也相同 |
16.水资源非常重要,联合国确定2003年为国际淡水年.海水淡化是海岛地区提供淡水的重要手段,所谓海水淡化是指除去海水中的盐分以获得淡水的工艺过程又称海水脱盐),其方法较多,如反渗透法、水合物法、电渗透法和压渗法等.下列方法中,不可以用来进行海水淡化的是( )
| A. | 过滤法 | B. | 蒸馏法 | C. | 膜分离法 | D. | 离子交换法 |
6.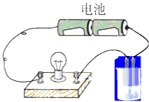 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
 用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )
用图所示的装置分别进行如下导电性实验,小灯泡的亮度比反应前明显减弱的是( )| A. | 向亚硫酸钠溶液中通入氯气 | B. | 向硝酸银溶液中通入少量氯化氢 | ||
| C. | 向氢碘酸饱和溶液中通入少量氧气 | D. | 向氢氧化钠溶液中通入少量氯气 |
11.下列离子组一定能大量共存的是( )
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |