��Ŀ����
����Ŀ�����������������Ҫ��������������������й㷺Ӧ�á����������ж����������γ��������Ҫ���塣������ʵ�����Ʊ����ǹ�ҵ��������������β�����ջ��������dz���Ҫ�����������գ�
(1)ʵ���ҿ���ͭ��Ũ������Ȼ�������������Ʒ�Ӧ��ȡ��������

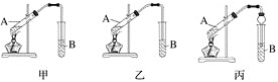
A��װ��a Bװ��b
C��װ��c D��װ��d
�����������������Ʒ�Ӧ��ȡ��������ϣ���ܿ��Ʒ�Ӧ�ٶȣ���ͼ�п�ѡ�õķ���װ���� _________(��д��ĸ)��
(2)����������������Ʒ�Ӧ��ȡ3.36 L(��״��)��������������Ҫ��ȡ��������____________________g(����һλС��)���������4.0%��������(��������)�������������ƣ����������ȡ����������________g (����һλС��)��
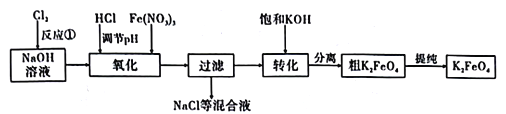
(3)ʵ���Ҷ�������β�������빤ҵ��������Ļ�ѧԭ����ͨ��ʯ�ң�ʯ�෨�ͼ�dz��õ���������ʯ�ң�ʯ�෨�����շ�ӦΪSO2��Ca(OH)2=CaSO3����H2O�����ղ�����������ɹܵ���������������������ӦΪ2CaSO3��O2��4H2O=2CaSO4��2H2O������������ͼ��
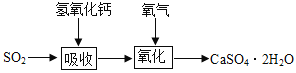
������շ�ӦΪSO2��2NaOH=Na2SO3��H2O������ص����������Ƽ���ǿ�����տ죬Ч�ʸߡ�����������ͼ��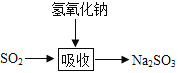
��֪��

ʯ�ң�ʯ�෨�ͼ���ն�������Ļ�ѧԭ����֮ͬ���� _____________________���ͼ��ȣ�ʯ�ң�ʯ�෨���ŵ���__________________��ȱ����__________________��
(4)��ʯ�ң�ʯ�෨�ͼ�Ļ����ϣ����һ���Ľ��ģ���ʵ������ѭ������������(������ͼ��ʾ) _______��
���𰸡� AD 18.9 19.8 ����SO2���������������Ӧ ԭ���ã����ճɱ��� ������������Ч�ʵ� 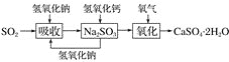
����������1��������������Ʒ�Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4=Na2SO4+H2O+SO2������Ӧ����Ϊ������+Һ���������ϣ���ܿ��Ʒ�Ӧ���ʣ�ʹ�÷�Һ©����
��2�����ݻ�ѧ����ʽNa2SO3+H2SO4=Na2SO4+H2O+SO2����2Na2SO3+O2=2Na2SO4��ʽ���㡣
��3��ʯ��-ʯ�෨�ͼ����SO2�Ļ�ѧԭ����֮ͬ��������SO2���������������Ӧ�����ݱ������ݣ�ʯ��-ʯ�෨���ŵ��ǣ�ԭ���ã����ճɱ��͡�����������Ϣ��ʯ��-ʯ�෨��ȱ������������������Ч�ʵ͡�
��4�����ڼ����SO2�����տ졢Ч�ʸߣ���������NaOH����SO2����NaOH�۸��������SO2�ijɱ��ߣ�����Ҫʵ��NaOH��ѭ�����ã����ʯ��-ʯ�෨���ŵ㣬��Na2SO3�м���Ca��OH��2��ʹNaOH������ͬʱ����CaSO3��CaSO3�����ɵõ�CaSO4��2H2O��
��1��������������Ʒ�Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4=Na2SO4+H2O+SO2������Ӧ����Ϊ������+Һ���������ϣ���ܿ��Ʒ�Ӧ���ʣ�ʹ�÷�Һ©������ѡ��װ��a��װ��d����ѡAD��
��2�����ݷ�ӦNa2SO3+H2SO4=Na2SO4+H2O+SO2����������n��Na2SO3��=n��SO2��=![]() =0.15mol��������Ҫ��ȡ�������Ƶ�����Ϊ0.15mol
=0.15mol��������Ҫ��ȡ�������Ƶ�����Ϊ0.15mol![]() 126g/mol=18.9g���������4.0%���������������������������������ƣ���ԭ���������Ƶ�����Ϊ18.9 g
126g/mol=18.9g���������4.0%���������������������������������ƣ���ԭ���������Ƶ�����Ϊ18.9 g![]() ��1-4.0%��=19.6875 g������2Na2SO3+O2=2Na2SO4��Na2SO3�������ɵ������Ƶ�����Ϊ��19.6875 g��18.9 g��
��1-4.0%��=19.6875 g������2Na2SO3+O2=2Na2SO4��Na2SO3�������ɵ������Ƶ�����Ϊ��19.6875 g��18.9 g��![]() =0.8875 g��������Ҫ��ȡ���ʺ���������Ƶ�����Ϊ18.9 g+0.8875 g
=0.8875 g��������Ҫ��ȡ���ʺ���������Ƶ�����Ϊ18.9 g+0.8875 g![]() 19.8 g��
19.8 g��
��3��ʯ��-ʯ�෨��ԭ���ǣ�SO2+Ca��OH��2=CaSO3��+H2O��2CaSO3+O2+4H2O=2CaSO4��2H2O�������SO2�ķ�Ӧԭ���ǣ�SO2+2NaOH=Na2SO3+H2O��ʯ��-ʯ�෨�ͼ����SO2�Ļ�ѧԭ����֮ͬ��������SO2���������������Ӧ�����ݱ������ݣ�Ca��OH��2�۸�͡�����SO2�ijɱ��ͣ�ʯ��-ʯ�෨���ŵ��ǣ�ԭ���ã����ճɱ��͡�����������Ϣ������ص����������Ƽ���ǿ�����տ죬Ч�ʸ�����ʯ��-ʯ�෨��ȱ������Ca��OH��2�ܽ�ȵͣ���Һ��������������������Ч�ʵ͡�
��4�����ڼ����SO2�����տ졢Ч�ʸߣ���������NaOH����SO2����NaOH�۸��������SO2�ijɱ��ߣ�����Ҫʵ��NaOH��ѭ�����ã����ʯ��-ʯ�෨���ŵ㣬��Na2SO3�м���Ca��OH��2��ʹNaOH������ͬʱ����CaSO3��CaSO3�����ɵõ�CaSO4��2H2O�������̿��Ա�ʾΪ��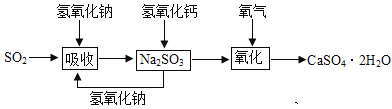 ��
��

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д� ��ٽ������½������������ϵ�д�
��ٽ������½������������ϵ�д�