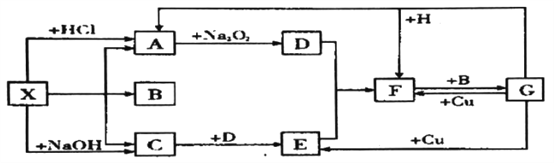
题目内容
【题目】中国营养学会修订颁布的“每日膳食营养素供给量”将硒(Se)列为15种每日膳食营养素之一,提出一个成年人每天对硒的适宜摄入量是50 ~250μg。回答下列有关问题:
(1) Se 原子的价电子排布式为_______,基态78 Se 原子中,核外存在______对自旋方向相反的电子。
(2)碱金属的硒化物溶液能够溶解硒,生成多硒化合物(M2Sex)。如多硒化钠Na2Se8,该物质中,化学键类型是________,Se原子之间形成的空间构型为_________________。
(3)As、S在元素周期表中均与Se 相邻,其氢化物分别是AsH3、H2Se和H2S其氢化物的稳定性强弱顺序为______________________。
(4)SeCl2和BeCl2均为1:2组成的分子,SeCl2中Se的轨道杂化类型是_______,BeCl2中Be的轨道杂化类型是_________________。
(5)Zn与Se同周期,S与Se同主族。由Zn与S形成的ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。ZnS晶胞结构如图所示,黑球代表的原子在晶胞内,白球代表的原子除在顶点外,其余的原子在晶胞_________ (填“内部”“棱上”或“面心”),若该晶体的密度为ρg·㎝-3,阿伏加德罗常数为NA mol-1,则立方晶胞的棱长=_____㎝(用含p、NA的代数式表示)。
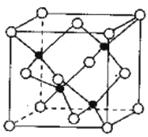
【答案】 4s24p4 16 离子键、共价键(或答“非极性共价键”,2分) 折线形或锯齿形或V形 H2S>H2Se>AsH3 sp3 sp 面心 ![]() 或
或![]()
【解析】本题考查选修3《物质结构》,主要考查基础知识,(1)Se位于第四周期VIA族元素,主族元素价电子指最外层电子数,Se的价电子排布式为4s24p4;每一个轨道最多容纳2个电子,且自旋方向相反,即Se有16对自旋方向相反的电子;(2)此物质为离子化合物,即含有离子键,Na最外层只有1个电子,因此Se原子间以共价键的形式结合,Se是sp3杂化,因此空间构型为V形;(3)同主族从上到下非金属性减弱,同周期从左向右非金属性增强,即S>Se>As,非金属性越强,其氢化物越稳定,即H2S>H2Se>AsH3;(4)SeCl2中Se形成2个σ键,孤电子对数=(6-2×1)/2=2,杂化类型为sp3,BeCl2中Be有2个σ键,孤电子对数=(2-2×1)/2=0,杂化类型为sp;(5)根据晶胞的结构,其余原子在晶胞的面心,晶胞的质量为4×97/NAg,设晶胞的边长为acm,则晶胞的体积为a3cm3,根据密度的定义,则a=![]() 或
或![]() 。
。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案