题目内容
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
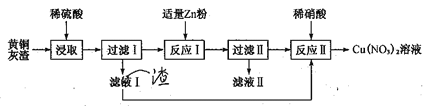
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
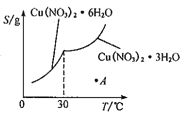
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
【答案】Fe2O3+6H+=2Fe3++3H2O加入过量的Zn会使最终所得的Cu(NO3)2溶液中含有杂质Zn2+、Fe2+3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O温度过高硝酸会挥发及分解,温度过低则反应速率较慢向溶液A中加入适量硝酸,将溶液A蒸发浓缩,冷却到30℃以上,过滤。
【解析】黄铜灰中加入稀硫酸,稀硫酸可Zn、CuO、ZnO、FeO、Fe2O3反应,滤渣1为铜和少量的SiO2,滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉可与Cu2+、H+反应生成铜和氢气,滤渣2主要为铜,将滤渣1和滤渣2用稀硝酸溶解并过滤除去SiO2后,即可得到Cu(NO3)2溶液,再将溶液蒸发、浓缩并结晶,即可得到Cu(NO3)2·3H2O;
(1)浸取时,Fe2O3与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
(2)滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入锌粉是为了置换出铜,如果Zn粉过量,则Cu中混合Fe和Zn,制得的Cu(NO3)2溶液不纯;
(3)滤液1主要含有Zn2+、Cu2+、Fe2+、H+,加入适量锌粉,锌粉可与Cu2+、H+还原生成铜和氢气,过虑后滤渣2主要为铜,滤液II中含有的金属阳离子主要有Cu2+、Fe2+;
(4)反应II是稀硝酸溶解Cu,生成Cu(NO3)2和NO,发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;反应II加热是为了提高反应速率,但温度过高
硝酸会挥发及分解,温度过低则反应速率较慢;
(5)A点对应的溶液为高温度下Cu(NO3)2的稀溶液,需要向溶液A中加入适量硝酸抑制Cu2+的水解,同时将溶液A蒸发浓缩,冷却到30℃以上,待析出晶体后再过滤,即可获取Cu(NO3)2·3H2O。

 金钥匙试卷系列答案
金钥匙试卷系列答案