题目内容
【题目】将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g)![]() CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
试计算:(1)H2的反应速率是多少?(2)CO的转化率为多少?
【答案】
(1)1.2 mol·L-1·s-1;(2)60%
【解析】
试题分析:设平衡时转化的CO的物质的量为n,则
2H2(气) + CO(气) ![]() CH3OH(气)
CH3OH(气)
起始(mol):6mol 3mol 0
转化(mol):2n n n
平衡(mol):(6mol-2n) (3mol-n) n
反应后气体的总物质的量为(6mol-2n)+(3mol-n)+n=9mol-2n
压强之比等于物质的量之比,
则![]() =0.6,n=1.8mol,则
=0.6,n=1.8mol,则
(1)(H2)=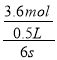 =1.2molL-1s-1,答:H2的反应速率是1.2molL-1s-1;
=1.2molL-1s-1,答:H2的反应速率是1.2molL-1s-1;
(2)CO的转化率为![]() ×100%=60%,答:CO的转化率为60%。
×100%=60%,答:CO的转化率为60%。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目

