题目内容
制取硝酸铵的流程图如下:?
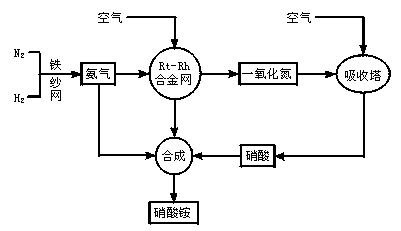
请回答下列问题:?
(1)合成氨的原料通常各来自何处??
(2)已知N2(g)+3H2(g) 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:
①什么是可逆反应??
②为有效提高氨的产率,实际生产中宜采取哪些措施??
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热??
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要??
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。

请回答下列问题:?
(1)合成氨的原料通常各来自何处??
(2)已知N2(g)+3H2(g)
 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:①什么是可逆反应??
②为有效提高氨的产率,实际生产中宜采取哪些措施??
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热??
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要??
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。
(1)N2取自于空气,H2可来自于水煤气;?
(2)①略;②可采取增压、适当温度和使用铁触媒等措施;?
(3)4NH3+5O2 4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?
4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?
(4)NH4NO3可作化肥和炸药。前者可促使植物生长,增加农作物产量;后者可用于军事、建设上制造炸药,故该物质对现代社会的发展与和平作用重大;?
(5)30% 17.6%?
(6)厂址的选择应具备以下有利条件:原料和产品运输方便,生产动力来源充足,废物易于处理,地价较便宜等。
(2)①略;②可采取增压、适当温度和使用铁触媒等措施;?
(3)4NH3+5O2
 4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?
4NO+6H2O,Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,保证Pt-Rt合金网达到一定温度而不必预热;?(4)NH4NO3可作化肥和炸药。前者可促使植物生长,增加农作物产量;后者可用于军事、建设上制造炸药,故该物质对现代社会的发展与和平作用重大;?
(5)30% 17.6%?
(6)厂址的选择应具备以下有利条件:原料和产品运输方便,生产动力来源充足,废物易于处理,地价较便宜等。
试题分析:(1)氮气主要来自于空气,而氢气可以自于水煤气等。
(2)①在相同条件下,既能向正反应方向进行,又能向逆反应方向进行的反应是可逆反应。②根据反应的方程式可知,该反应是体积减小的、放热的可逆反应。所以为有效提高氨的产率,实际生产中宜采取的措施可以是采取增压、适当温度和使用铁触媒等措施。
(3)氨气催化氧化的方程式是4NH3+5O2
 4NO+6H2O,其中Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,能保证Pt-Rt合金网达到一定温度而不必预热。
4NO+6H2O,其中Pt-Rh合金网起催化作用;因为氨的催化氧化反应是放热反应,能保证Pt-Rt合金网达到一定温度而不必预热。(4)NH4NO3可作化肥和炸药。前者可促使植物生长,增加农作物产量;后者可用于军事、建设上制造炸药,故该物质对现代社会的发展与和平作用重大。
(5)氮气和氢气的平均相对分子质量是8.5,所以二者的物质的量之比是
 。设反应前氮气和氢气的物质的量分别是1mol和3mol。则
。设反应前氮气和氢气的物质的量分别是1mol和3mol。则N2(g)+3H2(g)
 2NH3(g)
2NH3(g)起始量(mol) 1 3 0
转化量(mol) x 3x 2x
平衡量(mol)1-x 3-3x 2x
所以有

解得x=0.3
因此氮气的转化率是30%
平衡混合气体中NH3的体积分数为
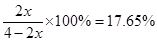
(6)厂址的选择应具备以下有利条件:原料和产品运输方便,生产动力来源充足,废物易于处理,地价较便宜等。
点评:本题是高考中典型的工艺流程题,试题综合性强,对学生的要求高。本题主要是考查考生运用化学反应原理及相关知识来解决工业生产中实际问题的能力。解此类型题目的基本步骤是:①从题干中获取有用信息,了解生产的产品。 ②分析流程中的每一步骤,从几个方面了解流程:A.反应物是什么;B.发生了什么反应;C.该反应造成了什么后果,对制造产品有什么作用。抓住一个关键点:一切反应或操作都是为获得产品而服务。③从问题中获取信息,帮助解题。

练习册系列答案
相关题目
 C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是  U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
 2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为
2NH3,在反应起始时N2和H2分别为1mol和3mol, 当达到平衡时,N2的转化率为30%,若以NH3为起始反应物,反应条件与上述反应相同,则NH3的起始的物质的量和它的转化率为  B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: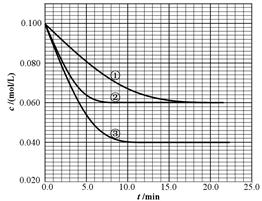
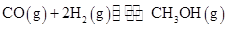 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。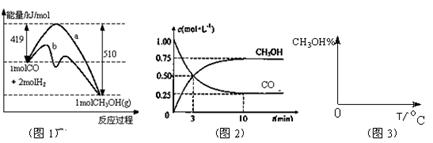
 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。 CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
 pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是( )
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是( )