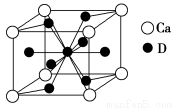
题目内容
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
元素 | 相关信息 |
X | X的最高价氧化物对应的水化物化学式为H2XO3 |
Y | Y是地壳中含量最高的元素 |
Z | Z的基态原子最外层电子排布式为3s23p1 |
W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)Z的第一电离能比W的________(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是________;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称________。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是________;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是_________________________________________________。
(1)三 ⅣA 大
(2)小 分子间作用力 乙酸(其他合理答案均可)
(3)先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液 Si+4HF=SiF4↑+2H2↑
【解析】 先根据题给条件判断元素的种类,再结合具体元素及其化合物的性质进行分析,在解决问题时要注意相关知识的综合应用。
(1)根据题给信息,可以初步判断X为第ⅣA族元素,当判断出Y为O元素时,即可确定X为C元素;Z的最外层电子数为3,共有三个电子层,所以Z为Al元素;由质子数=质量数-中子数,可以确定W的质子数为14,所以W为Si元素。由此可以判断W位于元素周期表第三周期第ⅣA族;W和X是同一主族元素,且W在X的下一周期,所以W的原子半径大于X的原子半径。(2)Z和W属于同周期元素,同周期元素的第一电离能从左向右呈逐渐增大趋势,所以Z的第一电离能小于W的;XY2为CO2,属于分子晶体,所以由固态变为气态时克服的作用力为分子间作用力;H、C、O三种元素可组成多种能形成同种分子间氢键的化合物,比如乙酸等。(3)Z单质即为铝,铝和盐酸反应生成氯化铝,向氯化铝中滴加氢氧化钠溶液,发生的反应主要分为两个阶段。第一阶段:先生成氢氧化铝沉淀;第二阶段:氢氧化钠过量时,氢氧化铝沉淀溶解。W单质即为硅,硅和氢氟酸反应生成SiF4和H2两种气体。