题目内容
(10分)下图是工业生产硝酸铵的流程。
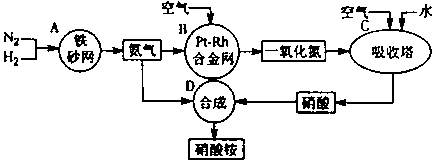
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = —1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=" " +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知: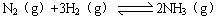 △H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
△H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。

(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = —1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=" " +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:
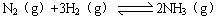 △H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
△H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
(10分,第1小题每空1分,其余每空2分)
(1)使NO全部转化成HNO3 (1分) ABC(2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol(2分)
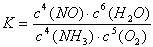 (1分)
(1分)
(3)CDE (2分)
(4)30%(或29.9%)(2分)
(1)使NO全部转化成HNO3 (1分) ABC(2分)
(2)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905.8kJ/mol(2分)
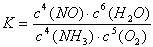 (1分)
(1分)(3)CDE (2分)
(4)30%(或29.9%)(2分)
略

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 CO2 (g)+H2 (g),恒容时,温度升高,H2浓度增大,则该正反应的焓变为正值
CO2 (g)+H2 (g),恒容时,温度升高,H2浓度增大,则该正反应的焓变为正值