题目内容
 Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.已知Q在所有原子中的原子半径最小,W是形成化合物种类最多的元素,Y的最外层电子数是内层电子数的3倍,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.(1)Z的离子结构示意图是
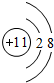
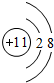
(2)Y和Z两种元素形成的简单离子的半径大小是
O2->Na+
O2->Na+
(用离子符号表示);其形成的原子个数比为1:1的化合物中存在的化学键类型是离子键、共价键
离子键、共价键
.(3)X和Z组成的一种离子化合物,能与水反应生成两种碱,其反应的化学方程是
Na3N+4H2O=3NaOH+NH3?H2O
Na3N+4H2O=3NaOH+NH3?H2O
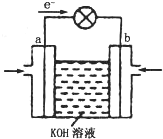
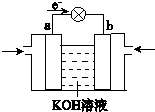
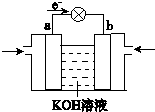
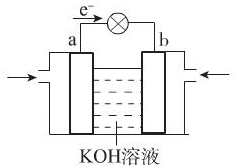
.(4)WQ4与Y2反应通过右图装置可将化学能转化为电能.
b电极通入的气体是
氧气
氧气
;a电极上发生的电极反应式是CH4+10OH--8e-=CO32-+7H2O
CH4+10OH--8e-=CO32-+7H2O
.分析:Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.Q在所有原子中的原子半径最小,则Q为氢元素;W是形成化合物种类最多的元素,则W为碳元素;Y的最外层电子数是内层电子数的3倍,则Y有2个电子层,最外层电子数为6,则W为氧元素;X原子序数介于碳元素与氧元素之间,则X为氮元素;Y和Z能形成原子个数比为1:1和1:2的两种离子化合物,则Z为Na元素,据此解答.
解答:解:Q、W、X、Y、Z是原子序数逐渐增大的短周期元素.Q在所有原子中的原子半径最小,则Q为氢元素;W是形成化合物种类最多的元素,则W为碳元素;Y的最外层电子数是内层电子数的3倍,则Y有2个电子层,最外层电子数为6,则W为氧元素;X原子序数介于碳元素与氧元素之间,则X为氮元素;Y和Z能形成原子个数比为1:1和1:2的两种离子化合物,则Z为Na元素,
(1)钠离子核外有2个电子层,最外层电子数为8,离子结构示意图是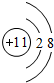 ,故答案为:
,故答案为: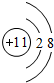 ;
;
(2)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,离子半径O2->Na+,过氧化钠中存在离子键、共价键,
故答案为:O2->Na+;离子键、共价键;
(3)X和Z组成的一种离子化合物,能与水反应生成两种碱,该离子化合物Na3N,与水反应生成氢氧化钠与一水合氨,反应化学方程式为:Na3N+4H2O=3NaOH+NH3?H2O,
故答案为:Na3N+4H2O=3NaOH+NH3?H2O;
(4)由电子流向可知,a为负极,b为正极,b极通入的气体为氧气,甲烷在a极反应氧化反应,在碱性条件下放电生成碳酸根、水,电极反应式:CH4+10OH--8e-=CO32-+7H2O,
故答案为:氧气;CH4+10OH--8e-=CO32-+7H2O.
(1)钠离子核外有2个电子层,最外层电子数为8,离子结构示意图是
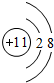 ,故答案为:
,故答案为: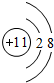 ;
;(2)O2-、Na+电子层结构相同,核电荷数越大离子半径越小,离子半径O2->Na+,过氧化钠中存在离子键、共价键,
故答案为:O2->Na+;离子键、共价键;
(3)X和Z组成的一种离子化合物,能与水反应生成两种碱,该离子化合物Na3N,与水反应生成氢氧化钠与一水合氨,反应化学方程式为:Na3N+4H2O=3NaOH+NH3?H2O,
故答案为:Na3N+4H2O=3NaOH+NH3?H2O;
(4)由电子流向可知,a为负极,b为正极,b极通入的气体为氧气,甲烷在a极反应氧化反应,在碱性条件下放电生成碳酸根、水,电极反应式:CH4+10OH--8e-=CO32-+7H2O,
故答案为:氧气;CH4+10OH--8e-=CO32-+7H2O.
点评:本题考查结构性质位置关系、常用化学用语、半径比较、化学键、原电池等,难度中等,推断元素是解题的关键,(4)中电极反应式书写可以利用总反应式减正极反应式.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
| A、氢化物稳定性:Z>W | B、原子半径的大小顺序:rX>rY>rQ>rW | C、元素Q和Z能形成QZ2型的共价化合物 | D、X、Y的最高价氧化物的水化物之间不能发生反应 |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.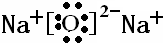

 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.