题目内容
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,工业上一般通过电解氧化物的方法获得Y的单质.W、Z最外层电子数相同,Z的核电荷数是W的2倍.五种元素最外层电子数之和为20.则下列说法不正确的是( )
分析:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,则X为钠元素;工业上一般通过电解氧化物的方法获得Y的单质,则Y为铝元素;W、Z最外层电子数相同,二者为同主族,Z的核电荷数是W的2倍,原子序数Z大于W,则W为氧元素,Z为硫元素;五种元素最外层电子数之和为20,则Q的最外层电子数为20-6-1-3-6=4,原子序数Q小于氧元素,故Q为碳元素.结合元素周期律及物质性质回答.
解答:解:Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色,则X为钠元素;工业上一般通过电解氧化物的方法获得Y的单质,则Y为铝元素;W、Z最外层电子数相同,二者为同主族,Z的核电荷数是W的2倍,原子序数Z大于W,则W为氧元素,Z为硫元素;五种元素最外层电子数之和为20,则Q的最外层电子数为20-6-1-3-6=4,原子序数Q小于氧元素,故Q为碳元素.
A、W为氧元素,Z为硫元素,同主族自上而下,非金属性减弱,非金属性O>S,故A正确;
B、X为钠元素,Y为铝元素,Z为硫元素,同周期随原子序数增大,原子半径减小,原子半径X>Y>Z,故B正确;
C、X为钠元素,Y为铝元素,同周期随原子序数增大,金属性减弱,所以金属性Na>Al,金属性越强,元素最高价氧化物对应水化物碱性越强,所以碱性X>Y,故C正确;
D、Q为碳元素,W为氧元素,同周期随原子序数增大,非金属性增强,非金属性O>C,非金属性越强,氢化物越稳定,氢化物稳定性Q<W,故D错误.
故选:D.
A、W为氧元素,Z为硫元素,同主族自上而下,非金属性减弱,非金属性O>S,故A正确;
B、X为钠元素,Y为铝元素,Z为硫元素,同周期随原子序数增大,原子半径减小,原子半径X>Y>Z,故B正确;
C、X为钠元素,Y为铝元素,同周期随原子序数增大,金属性减弱,所以金属性Na>Al,金属性越强,元素最高价氧化物对应水化物碱性越强,所以碱性X>Y,故C正确;
D、Q为碳元素,W为氧元素,同周期随原子序数增大,非金属性增强,非金属性O>C,非金属性越强,氢化物越稳定,氢化物稳定性Q<W,故D错误.
故选:D.
点评:考查元素位置结构性质的关系及应用,难度中等,元素推断是关键,学习中注重相关基础知识的积累.

练习册系列答案
相关题目
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
| A、氢化物稳定性:Z>W | B、原子半径的大小顺序:rX>rY>rQ>rW | C、元素Q和Z能形成QZ2型的共价化合物 | D、X、Y的最高价氧化物的水化物之间不能发生反应 |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
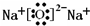
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.