��Ŀ����
����Ŀ��ijѧ��Ϊ�˲ⶨ���ֱ��ʵ�Na2SO3��Ʒ�Ĵ��ȣ��������ͼʵ�飬�ش��������⣺
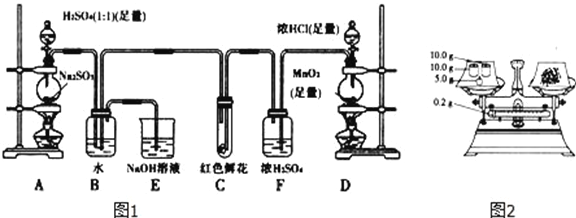
��1��д��Aװ���в������������ƣ��ƾ���__________________
��2��ʵ�鿪ʼ��д��B�з�Ӧ�����ӷ���ʽ__________________
��3��Eװ�õ�������__________________
��4����ͼ2��ʾ��ȡһ������Na2SO3��Ʒ����Aװ�õ���ƿ�У�����������H2SO4��ȫ��Ӧ��Ȼ��B����ȫ��Ӧ�����Һ��������BaCl2��Һ��Ӧ�����ˡ�ϴ�ӡ�����ð�ɫ����23.3g������Ʒ��Na2SO3�Ĵ���Ϊ__________________����ȷ��0.1%��
��5���ڹ��˳���ʱ����Һ���ֻ��ǣ������Ҫ�ظ�����������ѧ��û���ظ����ˣ���ⶨ�Ľ����__________________
��6��Ҫʹ�ⶨ���ȷ����һ��װ�������Ա������ã��ڶ���Ӧ�ȵ�ȼ__________________���ƾ��ƣ���װ����ĸ����
���𰸡� Բ����ƿ����Һ©�� Cl2+SO2+2H2O�T4H++2Cl��+SO42�� ����δ��Ӧ�Ķ��������������ֹ������Ⱦ 50.8% ƫ�� D
�����������⿼��ʵ�鷽����������ۣ���1������װ��ͼ�����������оƾ��ơ�Բ����ƿ����Һ©������2��װ��A�з���Na2SO3��H2SO4=Na2SO4��SO2����H2O��װ��D�з���MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O��װ��F�������Ǹ������������B���������ӷ�Ӧ��Cl2��SO2��2H2O=4H����2Cl����SO42������3��SO2��Cl2�ж�����Ⱦ������SO2�����������������NaOH��Ӧ��Cl2����NaOH��Ӧ�����NaOH���������ն���SO2��Cl2����ֹ��Ⱦ��������4��װ��A�з���Na2SO3��H2SO4=Na2SO4��SO2����H2O��װ��B����Cl2��SO2��2H2O=4H����2Cl����SO42����Ȼ�����BaCl2��Һ������Ba2����SO42��=BaSO4����������Ԫ���غ㣬�����Na2SO3��BaSO4�����Na2SO3������Ϊ23.3��126/233g=12.6g������ͼ2��Na2SO3��Ʒ����Ϊ(25��0.2)g=24.8g����Na2SO3�Ĵ���Ϊ12.6/24.8��100%=50.8%����5������ʱ����Һ���ǣ�˵����Һ����������BaSO4�����������������٣����Na2SO3�Ĵ���ƫ�ͣ���6��Ҫʹ�ⶨ���ȷ��װ�����������ã�Ӧ��ͨһ��ʱ�����������SO2ȫ����ȫ���գ�����ȵ�ȼD���ƾ��ơ�
MnCl2��Cl2����2H2O��װ��F�������Ǹ������������B���������ӷ�Ӧ��Cl2��SO2��2H2O=4H����2Cl����SO42������3��SO2��Cl2�ж�����Ⱦ������SO2�����������������NaOH��Ӧ��Cl2����NaOH��Ӧ�����NaOH���������ն���SO2��Cl2����ֹ��Ⱦ��������4��װ��A�з���Na2SO3��H2SO4=Na2SO4��SO2����H2O��װ��B����Cl2��SO2��2H2O=4H����2Cl����SO42����Ȼ�����BaCl2��Һ������Ba2����SO42��=BaSO4����������Ԫ���غ㣬�����Na2SO3��BaSO4�����Na2SO3������Ϊ23.3��126/233g=12.6g������ͼ2��Na2SO3��Ʒ����Ϊ(25��0.2)g=24.8g����Na2SO3�Ĵ���Ϊ12.6/24.8��100%=50.8%����5������ʱ����Һ���ǣ�˵����Һ����������BaSO4�����������������٣����Na2SO3�Ĵ���ƫ�ͣ���6��Ҫʹ�ⶨ���ȷ��װ�����������ã�Ӧ��ͨһ��ʱ�����������SO2ȫ����ȫ���գ�����ȵ�ȼD���ƾ��ơ�

 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�����Ŀ��CO2�����������壬Ҳ����Ҫ�Ļ���ԭ�ϣ���CO2Ϊԭ�Ͽɺϳɶ����л��
��1��CO2�����������״�����֪��2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X(X=n(H2)/n(CO2))��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
CH2=CH2(g)+4H2O(g) ��H=QkJ/mol��һ�������£�����ͬ��Ͷ�ϱ�X(X=n(H2)/n(CO2))��ij�ݻ��ɱ�ĺ�ѹ�ܱ������г���CO2��H2����ò�ͬͶ�ϱ�ʱCO2��ת�������¶ȵĹ�ϵ��ͼ��ʾ��
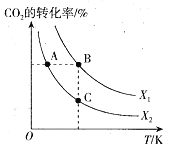
��X1_______X2���>����<������ͬ����Q_______0��
��ͼ��A��B��C�����Ӧ��ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ______��
��TKʱ���ڸ��ݻ��ɱ�ĺ�ѹ�ܱ������з���������Ӧ������й��������±���ʾ��
���ʵ���(mol) ʱ��(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
��֪��10minʱֻ�ı���һ����Ӧ�������øı������������______��
������������ܱ����÷�Ӧ�ﵽƽ��״̬����_____��
a.�����ܶȲ��� b.������ݵ�ƽ��Ħ���������� c.�������ʣ�2v(H2O)=v(CO2)
��3�������£���NaOH��Һ��CO2�����������Խ���̼�ŷţ����ҿɵõ���Ҫ�Ļ�����ƷNa2CO3��
�� ��ij�β���õ�pH=10����Һ������Һ��c(CO32-):c(HCO3-)=______ �۳�����K1(H2CO3)=4.4��10-7��K2(H2CO3)=5��10-11�ݡ�
�� ����5L Na2CO3��Һ��23.3 g BaSO4����ȫ��ת��ΪBaCO3�������õ�Na2CO3��Һ�����ʵ���Ũ������Ϊ_________��[��֪��������Ksp(BaSO4)=1��10-7��Ksp(BaCO3)=2.5��10-6]����������Һ������ı仯��