题目内容
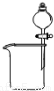
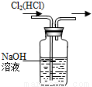
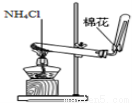
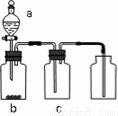
某化学兴趣小组欲设计使用如下装置验证:铜和一定量的浓硝酸反应有一氧化氮产生。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中溶液的体积变化)试回答下列问题:
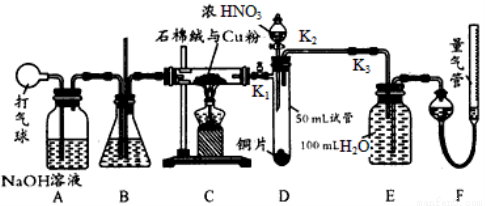
(1)在铜和浓硝酸反应前,挤压打气球,经A、B、C三个装置后,进入装置D中的气体是 (填化学式),通入该气体的目的是 ;进行此步操作时应关闭 (填“K1”“K2”或“K3”,下同),打开 。
(2)若装置C的硬质玻璃管中出现堵塞,则装置B中可能出现的现象是 。
(3)关闭K1、K2,打开K3,由分液漏斗向装置D的试管中滴加浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向装置D的试管中加入CCl4至满。则装置D的试管中一定发生的离子反应方程式为 。
(4)从装置E所得溶液中取出25.00 mL,用0.1000 mol/L的NaOH溶液进行中和,当恰好呈中性时消耗NaOH溶液18.00mL ,则装置E中所得硝酸的物质的量浓度为 。
(5)实验前量气管的液面读数为368.50 mL,实验后量气管的液面读数为224.00 mL。则上述铜和一定量的浓硝酸反应中 (填“有”或“无”)NO生成,写出推导过程 。
(1)N2;排出D中的空气;K3;K1、k2 (2)锥形瓶中玻璃管液面上升
(3)Cu + 2NO3-+ 4H+==Cu2+ +2NO2↑+ 2H2O (4)0.072mol/L
(5)有;装置E中得到100 mL硝酸时产生的NO约为80.64 mL,而试管中原有50 mL N2,二者之和为80.64 mL+ 50 mL=130.64 mL.而量气管测得的气体体积为368.50 mL -224.00 mL=144.50 mL,说明生 成NO2的同时有NO生成,且生成的NO体积为144.50 mL - 130.64 mL=13.86 mL。
【解析】
试题分析:(1)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是氮气;试管体积为50ml,进入的氮气体积为50ml,通入氮气目的是把试管中的空气排净,避免生成的一氧化氮气体被氧气氧化为二氧化氮,无法验证铜和浓硝酸反应产物中有一氧化氮气体生成,依据气体流向,开关操作是关闭K3,打开K1、K2,让氮气把试管中的空气赶净,更好的利用后续试验测定气体体积和验证一氧化氮气体的生成。
(2)若装置C的硬质玻璃管中出现堵塞,则导致气流不畅,因此B装置中压强增大,所以装置B中可能出现的现象是锥形瓶中玻璃管液面上升。
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜、二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜、一氧化氮和水;因此D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O。
(4)从E装置所得溶液中取出25.00mL,用0.1000mol?L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则设硝酸浓度为C,发生的反应实质是H++OH-=H2O,所以25.00mL×C=18.00mL×0.1000mol?L-1,解得C=0.0720mol/L。
(5)E装置中生成的硝酸溶液体积为100ml,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L=80.64ml,而试管中原有50 mL N2,二者之和为80.64 mL+ 50 mL=130.64 mL。而量气管测得的气体体积为368.50 mL -224.00 mL=144.50 mL,说明生成NO2的同时有NO生成,且生成的NO体积为144.50 mL - 130.64 mL=13.86 mL。
考点:考查硝酸与铜的有关判断、计算以及实验方案设计等

如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸 分子式:HCl 相对分子质量:36.5,密度:1.19 g·cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为__ ____mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取___ _____mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面 ( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ( )
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出