题目内容
在一恒温、恒容密闭容器中充入1mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。回答下列问题:
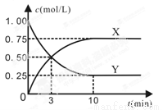
(1)Y的化学式是 。
(2)反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率v(H2)= mol·L-1·min-1。
(3)不能判断该反应达到化学平衡状态的依据是 。
A.容器内各气体的体积比保持不变 B.混合气体密度不变
C.3v逆(CH3OH) =v正(H2) D.H2转化率为75%
(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(5)上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
(1)CO2 (2)> 0.5 (3)B (4)向右 (5)0.19
【解析】
试题分析:(1)由图像可知生成物X的浓度变化是0.75mol/L,反应物Y的浓度变化也是0.75mol/L。根据反应方程式可知CO2(g)+3H2(g)  CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g)
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol,无论是哪种生成物,方程式的系数都是1,其改变量与反应物相同。则根据反应时各物质的关系可知只能是方程式中的系数为1的物质。因此Y的化学式是CO2。(2)反应进行到10min时得到化学平衡。所以在进行到3min时, v正> v逆,反应正向进行。反应前3min,V(CO2)=0.5mol/L÷3min=1/6mol/(L·min)。由于V(H2) =3V(CO2)=3×1/6mol/(L·min)= 0.5 mol/(L·min)。 (3)A.容器内各气体的体积比保持不变,则任何组分的物质的量不变,物质的量浓度不变,反应达到平衡。正确。B.由于反应是在一恒温、恒容密闭容器中进行。无论反应是否发生,也无论反应进行到哪种程度,由于容器的容积不变、物质的质量不变,所以混合气体密度不变。错误。C.在任何时刻都存在速率关系:3v正(CH3OH) =v正(H2),而3v逆(CH3OH) =v正(H2)。则v正(CH3OH)= v逆(CH3OH)。即用同一物质表示的反应速率V正=V逆。因此反应达到了平衡状态。正确。D.由图像可知:达到平衡状态时c(CO2)=0.25mol/L,改变了0.75mol/L.由于n(CO2):n(H2)=1:3,所以H2改变的浓度3×0.75mol/L,H2的起始浓度3mol/L.所以H2转化率为(3×0.75mol/L ÷3)×100%=75%。正确。因此不能判断该反应达到化学平衡状态的依据的选项是B。(4)上述反应达到平衡后,往容器中同时加入1molCO2和1mol H2O(g),由于增大了反应物的浓度,所以此时平衡将向右移动。(5)上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数
CO2(g) + 3H2(g)的平衡常数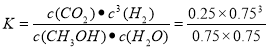 .解得K=0.19。
.解得K=0.19。
考点:考查反应时各物质浓度的关系、反应方向和化学平衡状态的判断、化学反应速率与化学平衡常数的计算的知识。