题目内容
下列溶液中离子浓度关系的表示正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO )+c(HCO )+c(HCO ) ) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-) |
C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH )>c(OH-) )>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中: |
D
解析试题分析:A.根据电荷守恒可知NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+2c(CO )+c(HCO
)+c(HCO ),错误;B.由于醋酸是弱酸,NaOH是强碱,所以pH=3的CH3COOH溶液与pH=11的NaOH溶液中c(CH3COOH)>c(NaOH)。等体积混合后的溶液中含有CH3COOH和CH3COONa.由于酸过量,醋酸的电离作用大于醋酸根离子的水解作用,所以c(H+) >c(OH-),错误;C.0.1 mol·L-1的NH4Cl溶液中:由于铵根离子的水解作用消耗,所以c(Cl-)> )>c(NH
),错误;B.由于醋酸是弱酸,NaOH是强碱,所以pH=3的CH3COOH溶液与pH=11的NaOH溶液中c(CH3COOH)>c(NaOH)。等体积混合后的溶液中含有CH3COOH和CH3COONa.由于酸过量,醋酸的电离作用大于醋酸根离子的水解作用,所以c(H+) >c(OH-),错误;C.0.1 mol·L-1的NH4Cl溶液中:由于铵根离子的水解作用消耗,所以c(Cl-)> )>c(NH )。水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,最终使溶液中c(H+>c(OH-),但是盐的水解作用程度是微弱的,所以c(NH
)。水解消耗水电离产生的氢氧根离子,破坏了水的电离平衡,最终使溶液中c(H+>c(OH-),但是盐的水解作用程度是微弱的,所以c(NH )>c(H+)。因此溶液中离子浓度的关系是:c(Cl-) >c(NH
)>c(H+)。因此溶液中离子浓度的关系是:c(Cl-) >c(NH )>c(H+) >c(OH-),错误;D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中,根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),正确。
)>c(H+) >c(OH-),错误;D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中,根据物料守恒可得:2c(Na+)=c(CH3COOH)+c(CH3COO-),正确。
考点:考查溶液中离子浓度的大小比较的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
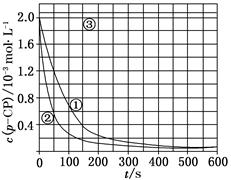
[数据处理] 实验测得p-CP的浓度随时间变化的关系如上图。
(2)请根据上图实验①曲线,计算降解反应50~150 s内的反应速率:
v(p-CP)=________mol·L-1·s-1。
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:_____________________________
(4)实验③得出的结论是:pH等于10时,________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:________。
常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的是
A.2c(H2CO3)+c(HCO )+c(H+) = c(OH-) )+c(H+) = c(OH-) |
B.c(Na+) = c(HCO )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO ) ) |
C.c(Na+)>c(H+)>c(OH-)>c(CO ) ) |
D.c(Na+)+c(H+) = c(HCO )+c(OH-)+ 2c(CO )+c(OH-)+ 2c(CO ) ) |
下列表述中,合理的是( )
| A.将水加热,Kw不变,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下列各离子浓度的大小比较,正确的是( )
| A.同浓度下列溶液中:① (NH4)2SO4 ② NH4HCO3 ③ NH4Cl④ NH3·H2O, c(NH4+)由大到小的顺序是:① > ③ > ② > ④ |
| B.常温时,将等体积的盐酸和氨水混合后,pH = 7,则c (NH4+) > c (Cl-) |
| C.0.2 mol·L-1 Na2CO3溶液中:c (OH-) =" c" (HCO3-) + c (H+) + c (H2CO3) |
| D.0.01 mol·L-1 的NH4Cl溶液与0.05mol·L-1 的NaOH溶液等体积混合: c (Cl-)> c (NH4+)> c (Na+)>c (OH-)>c (H+) |
常温时,将等质量的AgCl固体分别加入到等体积的下列4种溶液中,AgCl溶解最少的是
| A.1 mol/L的AlCl3溶液 | B.2mol/L的NaCl溶液 |
| C.1.4mol/L的BaCl2溶液 | D.1mol/L的MgCl2溶液 |
下列有关说法正确的是( )
| A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S) |
| B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+) |
| C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时, 溶液中  的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中: |
25℃时,将0.1mol·L-1氨水溶液加水稀释,下列数值变大的是
| A.c(OH-) | B.pH | C.c(NH4+)/c(NH3·H2O) | D.c(H+)·c(OH-) |
消毒液在日常生活中被广泛应用。某消毒液无色,pH>7,对某些有色物质有漂白作用。你认为它可能的有效成分是
| A.NaCl | B.Na2CO3 | C.KMnO4 | D.NaClO |