جâؤ؟ؤعبف
،¾جâؤ؟،؟¢ٌ،¢دضسذبçح¼¼¸ضضسذ»ْخï£؛

اëہûسأبçح¼¸ّ³ِµؤخïضت°´زھاَ»ط´ًدآءذختجâ£؛
£¨1£©دà¶ش·ض×سضتء؟خھ44µؤحéجµؤ½ل¹¹¼ٍت½خھ__£»
£¨2£©·ض×سضذ؛¬سذ14¸ِاâش×سµؤحéجµؤ·ض×ست½تا__£»
£¨3£©سë¢غ»¥خھح¬·ضزى¹¹جهµؤتا__£¨جîذٍ؛إ£©£»
£¨4£©¾كسذجطتâئّخ¶£¬³£×÷فحب،¼ءµؤسذ»ْخïشعجْ×÷´ك»¯¼ءµؤجُ¼دآسëز؛نه·¢ةْز»ب،´ْ·´س¦µؤ»¯ر§·½³جت½__£»
£¨5£©سأ،°£¾،±±يت¾¢ظ¢غ¢ـ¢لبغ·ذµم¸كµحث³ذٍ£؛__£¨جîذٍ؛إ£©£»
£¨6£©سذ»ْخï¢عشع¼سببجُ¼دآ؛حCuO·´س¦µؤ»¯ر§·½³جت½__£»
£¨7£©شع120،و£¬1.01،ء105Paجُ¼دآ£¬ؤ³ضضئّج¬جسë×مء؟µؤO2حêب«·´س¦؛َ£¬²âµأ·´س¦ا°؛َئّجهµؤجه »أ»سذ·¢ةْ¸ؤ±ن£¬شٍ¸أجتا__£¨جîذٍ؛إ£©£»ثüسë¢à»¥خھ__¹طدµ£»
£¨8£©سذ»ْخï¢ف؛ح¢عشعز»¶¨جُ¼دآ·¢ةْ·´س¦µؤ»¯ر§·½³جت½تا__£®
¢ٍ،¢سحض¬µؤ×é³ة؟ةسأ،° ،±ہ´±يت¾£¬ئنضذRخھج¼ش×ستؤ؟¶àسع10µؤء´ج»ù£¬؟ةزشدàح¬ز²؟ةزش²»ح¬،£·ض×ست½خھC51H92O6µؤؤ³سحض¬شعد،ءٍثلضذ¼سببث®½â؛َµأµ½A،¢Bء½ضضخïضت£¬بôAµؤدà¶ش·ض×سضتء؟خھ92(زرضھ£؛R1،ھCH===CH،ھR2
،±ہ´±يت¾£¬ئنضذRخھج¼ش×ستؤ؟¶àسع10µؤء´ج»ù£¬؟ةزشدàح¬ز²؟ةزش²»ح¬،£·ض×ست½خھC51H92O6µؤؤ³سحض¬شعد،ءٍثلضذ¼سببث®½â؛َµأµ½A،¢Bء½ضضخïضت£¬بôAµؤدà¶ش·ض×سضتء؟خھ92(زرضھ£؛R1،ھCH===CH،ھR2![]() R1،ھCOOH£«R2،ھCOOH)£¬شٍ
R1،ھCOOH£«R2،ھCOOH)£¬شٍ
£¨1£©Bµؤ·ض×ست½خھ________£¬Aµؤ½ل¹¹¼ٍت½خھ________،£
£¨2£©B![]() C£«D£¬µبخïضتµؤء؟µؤC،¢D·ض±ًسë×مء؟µؤNaOHبـز؛·´س¦ت±£¬دû؛ؤµؤNaOHµؤضتء؟ض®±بخھ1،أ2£¬C،¢Dµؤدà¶ش·ض×سضتء؟دà²î30ازC،¢D½ل¹¹ضذ¾ùخقض§ء´£¬شٍBµؤ½ل¹¹¼ٍت½خھ________،£
C£«D£¬µبخïضتµؤء؟µؤC،¢D·ض±ًسë×مء؟µؤNaOHبـز؛·´س¦ت±£¬دû؛ؤµؤNaOHµؤضتء؟ض®±بخھ1،أ2£¬C،¢Dµؤدà¶ش·ض×سضتء؟دà²î30ازC،¢D½ل¹¹ضذ¾ùخقض§ء´£¬شٍBµؤ½ل¹¹¼ٍت½خھ________،£
£¨3£©بôA؛حززثلشعز»¶¨جُ¼دآ·´س¦؛َةْ³ةدà¶ش·ض×سضتء؟خھ134µؤE£¬ذ´³ِEثùسذ؟ةؤـµؤ½ل¹¹¼ٍ ______________________________________،£
،¾´ً°¸،؟ CH3CH2CH3 C6H14 ¢ك ![]() +Br2
+Br2![]()
![]() +HBr ¢ـ£¾¢غ£¾¢ل£¾¢ظ CH3CH2OH+CuO
+HBr ¢ـ£¾¢غ£¾¢ل£¾¢ظ CH3CH2OH+CuO![]() CH3CHO+Cu+H2O ¢ظ ح¬دµخï CH3COOH+CH3CH2OH
CH3CHO+Cu+H2O ¢ظ ح¬دµخï CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O C16H30O2 CH2OHCHOHCH2OH CH3(CH2)6CH===CH(CH2)6COOH
CH3COOCH2CH3+H2O C16H30O2 CH2OHCHOHCH2OH CH3(CH2)6CH===CH(CH2)6COOH 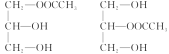
،¾½âخِ،؟¢ٌ،¢(1)حéجµؤح¨ت½خھ£؛CnH2n+2£¬دà¶ش·ض×سضتء؟خھ44µؤحéج£¬شٍ12n+2n+2=44£¬ثùزشn=3£¬¼´حéجµؤ·ض×ست½خھC3H8£¬½ل¹¹¼ٍت½خھCH3CH2CH3£¬¹ت´ً°¸خھ£؛CH3CH2CH3£»
(2)سةحéجµؤح¨ت½CnH2n+2£¬شٍ2n+2=14£¬½âµؤn=6£¬حéجخھC6H14£¬¹ت´ً°¸خھ£؛C6H14£»
(3)سë¢غ»¥خھح¬·ضزى¹¹جهµؤتا¢ك£¬¶صك·ض×ست½دàح¬£¬½ل¹¹²»ح¬£¬¹ت´ً°¸خھ£؛¢ك£»
(4)¾كسذجطتâئّخ¶£¬³£×÷فحب،¼ءµؤسذ»ْخïخھ±½£¬شعجْ×÷´ك»¯¼ءµؤجُ¼دآسëز؛نه·¢ةْز»ب،´ْ·´س¦µؤ»¯ر§·½³جت½خھ![]() £¬¹ت´ً°¸خھ£؛
£¬¹ت´ً°¸خھ£؛![]() £»
£»
(5)ج¼ش×س¸ِتش½¶à£¬·ذµمش½´َ£¬دàح¬ج¼ش×س¸ِتµؤحéجضذض§ء´¶àµؤ·ذµمµح£¬شٍ·ذµمخھ¢ـ£¾¢غ£¾¢ل£¾¢ظ£¬¹ت´ً°¸خھ£؛¢ـ£¾¢غ£¾¢ل£¾¢ظ£»
(6)زز´¼سëCuO·´س¦ةْ³ةززب©،¢Cu؛حث®£¬·´س¦خھCH3CH2OH+CuO![]() CH3CHO+Cu+H2O£¬¹ت´ً°¸خھ£؛CH3CH2OH+CuO
CH3CHO+Cu+H2O£¬¹ت´ً°¸خھ£؛CH3CH2OH+CuO![]() CH3CHO+Cu+H2O£»
CH3CHO+Cu+H2O£»
(7)شع120،و£¬1.01،ء105Paجُ¼دآ£¬ةْ³ةµؤث®خھئّج¬£¬سةCxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O(g)£¬شٍ 1+(x+
H2O(g)£¬شٍ 1+(x+![]() )=x+
)=x+![]() £¬½âµأy=4£¬¼´·ض×ست½ضذاâش×ستؤ؟خھ4£¬خھ¼×ح飬ثüسë¢à»¥خھح¬دµخ¹ت´ً°¸خھ£؛¢ظ£»ح¬دµخ
£¬½âµأy=4£¬¼´·ض×ست½ضذاâش×ستؤ؟خھ4£¬خھ¼×ح飬ثüسë¢à»¥خھح¬دµخ¹ت´ً°¸خھ£؛¢ظ£»ح¬دµخ
(8)ززثلسëزز´¼·¢ةُْ¥»¯·´س¦ةْ³ةززثلززُ¥؛حث®£¬¸أ·´س¦خھCH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O£¬¹ت´ً°¸خھ£؛CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O£¬¹ت´ً°¸خھ£؛CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O£»
CH3COOCH2CH3+H2O£»
¢ٍ،¢سذ»ْخïAµؤدà¶ش·ض×سضتء؟خھ92£¬Aخھسحض¬ث®½âµؤ²ْخشٍAخھ¸تسح£¬½ل¹¹¼ٍت½خھ![]() £¬¸أسحض¬µؤ²»±¥؛ح¶بخھ
£¬¸أسحض¬µؤ²»±¥؛ح¶بخھ![]() =6£¬ةْ³ةخïBضذ؛¬سذ1¸ِج¼ج¼ث«¼ü£¬ج¼ش×ستؤ؟خھ
=6£¬ةْ³ةخïBضذ؛¬سذ1¸ِج¼ج¼ث«¼ü£¬ج¼ش×ستؤ؟خھ![]() =16£¬¹تBخھC16H30COOH،£
=16£¬¹تBخھC16H30COOH،£
(1)سةةدتِ·ضخِ؟ةضھ£¬Bµؤ½ل¹¹¼ٍت½خھC16H30COOH£¬·ض×ست½خھC16H30O2£¬Aأû³ئخھ±ûب´¼»ٍ¸تسح£¬½ل¹¹¼ٍت½خھ![]() £¬¹ت´ً°¸خھ£؛C16H30O2£»
£¬¹ت´ً°¸خھ£؛C16H30O2£»![]() £»
£»
(2)B·ض×سضذ´وشعج¼ج¼ث«¼ü£¬شعثلذشKMnO4بـز؛رُ»¯دآ£¬ز»¸ِج¼ج¼ث«¼ü±ن³ةء½¸ِ-COOH£¬µبخïضتµؤء؟µؤC،¢D·ض±ًسë×مء؟µؤNaOHبـز؛·´س¦ت±£¬دû؛ؤµؤNaOHµؤخïضتµؤء؟ض®±بخھ1£؛2£¬شٍCتاز»شھثل،¢Dتا¶شھثل£¬C،¢Dµؤدà¶ش·ض×سضتء؟دà²î30£¬شٍC،¢D·ض×سضذ¾ùسذ8¸ِج¼ش×س£¬ازC،¢D½ل¹¹ضذ¾ùخقض§ء´£¬شٍCDخھH3C(CH2)6COOH؛حHOOC(CH2)6COOH£¬ؤوحئ؟ةµأBخھCH3(CH2)6CH=CH(CH2)6COOH£¬¹ت´ً°¸خھ£؛CH3(CH2)6CH=CH(CH2)6COOH£»
(3)Aخھ![]() £¬A؛حززثلشعز»¶¨جُ¼دآ·´س¦؛َةْ³ةدà¶ش·ض×سضتء؟خھ134µؤE£¬شٍEخھ¸تسح؛حززثلµبخïضتµؤء؟ُ¥»¯µؤ²ْخE؟ةؤـµؤ½ل¹¹¼ٍت½سذ
£¬A؛حززثلشعز»¶¨جُ¼دآ·´س¦؛َةْ³ةدà¶ش·ض×سضتء؟خھ134µؤE£¬شٍEخھ¸تسح؛حززثلµبخïضتµؤء؟ُ¥»¯µؤ²ْخE؟ةؤـµؤ½ل¹¹¼ٍت½سذ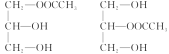 £¬¹ت´ً°¸خھ£؛
£¬¹ت´ً°¸خھ£؛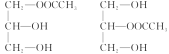 ،£
،£

،¾جâؤ؟،؟£¨¢ٌ£©ؤ³»¯ر§ذثب¤ذ،×éزھحê³ةضذ؛حببµؤ²â¶¨£®»ط´ًدآءذختجâ£؛
£¨1£©تµرé×ہةد±¸سذ´َ،¢ذ،ء½¸ِةص±،¢إفؤثـءد،¢إفؤثـءد°ه،¢½؛ح·µخ¹ـ،¢»·ذخ²£ء§½ء°è°ô،¢0.5molL©پ1رخثل،¢0.55molL©پ1NaOHبـز؛£¬تµرéةذب±ةظµؤ²£ء§سأئ·تا_______£®
£¨2£©زرضھ£؛·´س¦؛َبـز؛µؤ±ببببفcخھ4.18J،¤،و©پ1g©پ1£¬0.5molL©پ1رخثل؛ح0.55mol،¤L©پ1NaOHبـز؛µؤأـ¶ب¾ùخھ1g،¤cm©پ3£®تµرéت±¼اآ¼µؤتµرéت¾فبçدآ£؛
تµرé ´خت | ·´س¦خï¼°سأء؟ | بـ ز؛ خآ ¶ب | ||
t1 | t2 | |||
1 | 50mL0.55molL-1NaOHبـز؛ | 50mL.0.5molL-1HClبـز؛ | 20،و | 23.3،و |
2 | 50mL0.55molL-1NaOHبـز؛ | 50mL.0.5molL-1HClبـز؛ | 20،و | 23.5،و |
¢ظرخثل؛حاâرُ»¯ؤئ·´س¦µؤضذ؛حبب،÷H1=____________£¨±£ءôء½خ»ذ،ت£©
¢عزرضھ£؛CH3COOH(aq)![]() CH3COO-(aq)+H+(aq) ،÷H2>0 ,
CH3COO-(aq)+H+(aq) ،÷H2>0 ,
CH3COOH(aq)+OH-(aq)= CH3COO-(aq)+H20(l) ،÷H3 شٍ،÷H3_____،÷H1£¨جî،°>،±،¢،°<،±،¢،°=،±£©
£¨¢ٍ£©ؤ³تµرéذ،×éہûسأءٍثلثل»¯µؤKMnO4سëH2C2O4·´س¦ہ´ج½¾؟،°حâ½çجُ¼¶ش»¯ر§·´س¦ثظآتµؤس°دى،±،£¸أذ،×éتµرé·½°¸بçدآ(تµرé²â¶¨KMnO4بـز؛حêب«حتة«ت±¼ن)،£»ط´ًدآءذختجâ£؛
تµرé ±à؛إ | H2C2O4بـز؛ | ثلذشKMnO4بـز؛ | H2O/mL | خآ¶ب/،و | KMnO4بـز؛حêب«حتة«ت±¼ن£¨s£© | ||
إ¨¶ب/mol،¤L-1 | جه»/mL | إ¨¶ب/mol،¤L-1 | جه»/mL | ||||
¢ظ | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
¢ع | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
¢غ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
£¨3£©ةدتِ·´س¦µؤہë×س·½³جت½خھ______________________________________
£¨4£©t1_____ t2£¨جî،°>،±،¢،°<،±،¢،°=،±£©£¬ئنہيسةتا__________________
£¨5£©تµرé¢ع؛حتµرé¢غء½×éتµرéµؤؤ؟µؤتا______________________________
£¨6£©سذح¬ر§×ِتµرéت±·¢دض£¬ءٍثلثل»¯µؤKMnO4سëH2C2O4·´س¦؟ھت¼ت±£¬بـز؛حتة«آ£¬µ«·´س¦ز»¶خت±¼ن؛َبـز؛حتة«أ÷دش¼س؟ى،£صë¶شةدتِتµرéدضدَ£¬¸أح¬ر§جل³ِدآءذ²آدë£؛
²آدë¢ظ£؛ءٍثلثل»¯µؤKMnO4سëH2C2O4·´س¦تا·إبب·´س¦£¬µ¼ضآبـز؛خآ¶بة¸ك£¬·´س¦ثظآت¼س؟ى،£
²آدë¢ع£؛__________________£¨اëؤم²¹³ن£©
زھض¤تµ²آدë¢ع£¬³ءٍثلثل»¯µؤ¸كأجثل¼طبـز؛،¢²فثلبـز؛ح⣬»¹ذèزھر،شٌµؤتش¼ءتا______،£
A.ءٍثل¼ط B.ءٍثلأج C.ث® D.آب»¯أج
