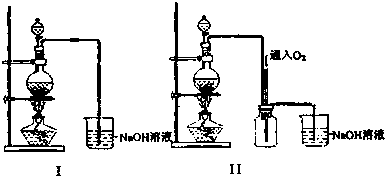
题目内容
17.一块已被部分氧化为Na2O的钠块10.8g,将其投入一定量水中,最终得到16g NaOH溶液,则原固体中氧化钠的质量是( )| A. | 8.5g | B. | 10.8g | C. | 6.2g | D. | 4.6g |
分析 设出钠块中钠、氧化钠的物质的量,分别根据总质量、钠元素守恒列式计算出氧化钠的物质的量,最后m=nM计算出氧化钠的质量.
解答 解:aOH溶液中含有NaOH的物质的量为$\frac{16g}{40g/mol}$=0.4mol,
设该钠块中含有钠、氧化钠的物质的量分别为x、y,
则:23x+62y=10.8、x+2y=0.4,
联立解得:x=0.2、y=0.1mol,
则原固体中氧化钠的质量为:62g/mol×0.1mol=6.2g,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度的关系为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
8.下列有关化学用语使用正确的是( )
| A. | NH3的电子式: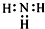 | |
| B. | S2-的结构示意图: | |
| C. | 中子数为146、质子数为92的铀(U)原子${\;}_{92}^{146}$U | |
| D. | 氮气分子的结构式:N-N |
8.影响化学反应速率的因素很多,下列措施一定能加快化学反应速率的是( )
| A. | 升高温度 | B. | 增大压强 | C. | 降低温度 | D. | 改变反应物用量 |
2.在150℃1.0×105Pa条件下将1L C2H4、2L C2H2、2L C2H6与20L O2混合点燃,完全反应后的混合气体恢复到原状态时,其体积为( )
| A. | 10L | B. | 15L | C. | 20L | D. | 25L |
9.下列叙述不正确的是( )
| A. | 符合通式:CnH2n-2的有机物一定是炔烃 | |
| B. | 乙炔分子中碳碳叁键的键能不是碳碳单键和碳碳双键的键能之和 | |
| C. | 等质量的烃中含氢量越高,充分燃烧时,消耗的氧气越多 | |
| D. | 1-丁炔分子中的四个碳原子在同一条直线上 |
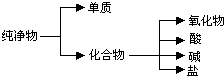 (1)纯净物根据其组成和性质可进行如下分类:
(1)纯净物根据其组成和性质可进行如下分类: