题目内容
10.现有三种有机物甲、乙、丙,其结构如图所示: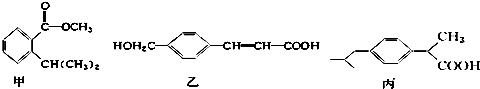
下列有关说法中错误的是( )
| A. | 甲、乙、丙都是芳香族化合物,只有两种能与碳酸氢钠溶液反应 | |
| B. | 只用碳酸氢钠溶液和银氨溶液能检验甲、乙、丙 | |
| C. | 与足量氢气反应,相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3:4:3 | |
| D. | 甲的化学式为C11H14O2,乙含有两种含氧官能团 |
分析 A.三种有机物都含有苯环,能与碳酸氢钠溶液反应的官能团为羧基;
B.都不含有醛基,不能用银氨溶液检验;
C.能与氢气的反应的为苯环和碳碳双键;
D.根据结构简式确定分子式,乙含有羟基、碳碳双键和羧基.
解答 解:A.三种有机物都含有苯环,都是芳香族化合物,乙、丙含有羧基,能与碳酸氢钠溶液反应,故A正确;
B.乙、丙含有羧基,能与碳酸氢钠溶液反应,不能鉴别,且都不含有醛基,不能用银氨溶液检验,故B错误;
C.能与氢气的反应的为苯环和碳碳双键,甲、丙都只有苯环与氢气反应,乙中苯环、碳碳双键可与氢气反应,则相同物质的量的甲、乙、丙消耗氢气的物质的量之比为3:4:3,故C正确;
D.由结构简式可知甲的化学式为C11H14O2,乙含有羟基、碳碳双键和羧基,含有两种含氧官能团,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、烯烃以及羧酸性质规律、有机物鉴别的考查,题目难度不大.

练习册系列答案
相关题目
14.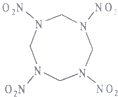 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
 高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )
高能材料HMX(结构如图所示)可作核武器的超爆装药和固体火箭推进剂的组分,爆炸时产生氢气、二氧化碳、水.下列说法正确的是( )| A. | HMX分子式为C4N8O8 | |
| B. | HMX中,所有C、N原子共平面 | |
| C. | 爆炸反应是,N2既是还原产物又是氧化产物 | |
| D. | 29.6gHMX完全燃烧产生二氧化碳8.96L |
5.短周期元素X、Y、Z的原子序数依次递增,三种元素的最外层电子数之和等于Z的原子序数.Y原子的最外层电子数是X原子内层电子数的3倍或者是Z原子最外层电子数的3倍.下列说法正确的是( )
| A. | X、Y元素能与氢形成分子式为H2XY2、H4X2Y2等弱酸 | |
| B. | 化合物ZY2中只含有离子键 | |
| C. | 工业上可用X单质置换ZY得到Z单质 | |
| D. | Y的氢化物的沸点比其下一周期的同族元素的氢化物的沸点低 |
15.断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出的四种毒素的结构式,下列推断正确的是( )


| A. | ①和②、③与④分别互为同分异构体 | |
| B. | ①、③互为同系物 | |
| C. | ①、②、③、④均能与氢氧化钠溶液反应 | |
| D. | 等物质的量的②、④分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
20.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |