题目内容
向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为
- A.0.21mol
- B.0.24mol
- C.0.16mol
- D.0.14mol
A
分析:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=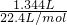 =0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,结合铁守恒计算.
=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,结合铁守恒计算.
解答:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=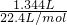 =0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为
=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为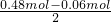 =0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,
=0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,
故选A.
点评:本题考查混合物的计算,题目难度不大,注意从守恒的角度解答该题较为直观,答题时注意体会.
分析:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=
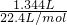 =0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,结合铁守恒计算.
=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,结合铁守恒计算.解答:n(HNO3)=0.12L×4mol/L=0.48mol,n(NO)=
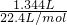 =0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为
=0.06mol,往所得溶液中加入KSCN溶液,无红色出现,说明全部生成Fe2+,溶液溶质为Fe(NO3)2,则原混合物中Fe为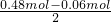 =0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,
=0.21mol,则若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为0.21mol,故选A.
点评:本题考查混合物的计算,题目难度不大,注意从守恒的角度解答该题较为直观,答题时注意体会.

练习册系列答案
相关题目
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合溶液中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现.若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为( )
| A、0.30mol | B、0.28mol | C、0.25mol | D、0.22mol |