题目内容
下列化学原理表述正确的是
| A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大; |
| B.Na2CO3溶液中满足:c(Na+)=2c( CO32-)+2 c( HCO3-)+ 2c (H2CO3) |
C.NaHCO3溶液不显中性的原因:HCO3-+H2O CO32-+H3O+ CO32-+H3O+ |
| D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多; |
B
A.稀释促进弱电解质的电离,但溶液的酸性减弱,H+浓度减小
B.遵循物料守恒,正确
C.NaHCO3溶液显碱性,是因为溶质水解:HCO3-+H2O H2CO3+OH-
H2CO3+OH-
D.两溶液的pH相同,即H+浓度相同,与锌反应时,开始时反应速率相同,但随着反应的时行,弱酸酸酸可不断电离出氢离子,反应速率反而相对较大,并且最终生成的氢气相对多
故答案为B
B.遵循物料守恒,正确
C.NaHCO3溶液显碱性,是因为溶质水解:HCO3-+H2O
 H2CO3+OH-
H2CO3+OH-D.两溶液的pH相同,即H+浓度相同,与锌反应时,开始时反应速率相同,但随着反应的时行,弱酸酸酸可不断电离出氢离子,反应速率反而相对较大,并且最终生成的氢气相对多
故答案为B

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
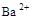 的溶液中,下列离子还能大量存在的是
的溶液中,下列离子还能大量存在的是