题目内容
制备氮化镁的装置示意图如下:
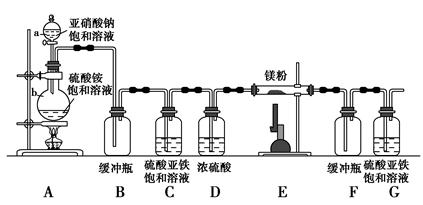
回答下列问题:
(1)检查装置气密性的方法是_______________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式______________________________;
(3)C的作用是______________________________________,
D的作用是_______________________________________,
是否可以把C和D的位置对调并说明理由____________________________;
(4)写出E中发生反应的化学方程式______________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象__________________________________________________

回答下列问题:
(1)检查装置气密性的方法是_______________________________________,
a的名称是________,b的名称是________;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式______________________________;
(3)C的作用是______________________________________,
D的作用是_______________________________________,
是否可以把C和D的位置对调并说明理由____________________________;
(4)写出E中发生反应的化学方程式______________________________;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象__________________________________________________
(1)微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)2NaNO2+(NH4)2SO4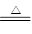 2N2↑+Na2SO4+4H2O
2N2↑+Na2SO4+4H2O
(3)除去氧气及氮氧化物 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg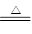 Mg3N2
Mg3N2
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁
(2)2NaNO2+(NH4)2SO4
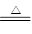 2N2↑+Na2SO4+4H2O
2N2↑+Na2SO4+4H2O(3)除去氧气及氮氧化物 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg
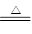 Mg3N2
Mg3N2(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁
(1)因为装置比较复杂,所以在检查装置气密性的时候要采取加热法,即微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;(2)根据反应物(NaNO2和(NH4)2SO4)和生成物(N2)。可知该反应为归中反应,所以化学方程式为2NaNO2+(NH4)2SO4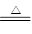 2N2↑+Na2SO4+4H2O;(3)从A中出来的气体中可能含有O2,对后面的实验会带来干扰,所以在和Mg反应之前必须除去,而饱和的硫酸亚铁溶液中含有(Fe2+),能除去O2;生成物Mg3N2极易和水发生反应,所以在制取反应前必须干燥(即浓硫酸的作用);(5)根据Mg3N2和H2O反应的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知检验方法为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。
2N2↑+Na2SO4+4H2O;(3)从A中出来的气体中可能含有O2,对后面的实验会带来干扰,所以在和Mg反应之前必须除去,而饱和的硫酸亚铁溶液中含有(Fe2+),能除去O2;生成物Mg3N2极易和水发生反应,所以在制取反应前必须干燥(即浓硫酸的作用);(5)根据Mg3N2和H2O反应的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知检验方法为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。
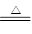 2N2↑+Na2SO4+4H2O;(3)从A中出来的气体中可能含有O2,对后面的实验会带来干扰,所以在和Mg反应之前必须除去,而饱和的硫酸亚铁溶液中含有(Fe2+),能除去O2;生成物Mg3N2极易和水发生反应,所以在制取反应前必须干燥(即浓硫酸的作用);(5)根据Mg3N2和H2O反应的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知检验方法为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。
2N2↑+Na2SO4+4H2O;(3)从A中出来的气体中可能含有O2,对后面的实验会带来干扰,所以在和Mg反应之前必须除去,而饱和的硫酸亚铁溶液中含有(Fe2+),能除去O2;生成物Mg3N2极易和水发生反应,所以在制取反应前必须干燥(即浓硫酸的作用);(5)根据Mg3N2和H2O反应的方程式:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,可知检验方法为取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。
练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
 H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1
H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1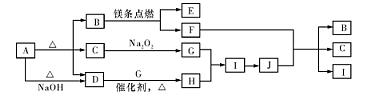
 KCl+2NH3↑
KCl+2NH3↑

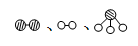 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)