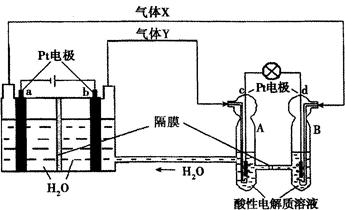
题目内容
将0.2 mol AgNO3、0.4 mol Cu(NO3)2、0.6 mol KCl溶于水,配成100 mL溶液,用石墨电极电解一段时间后,若在一极析出0.3 mol Cu,试计算另一极上产生的气体体积(标准状况)。
5.6 L
解析试题分析:三种物质溶于水时,AgNO3与KCl反应后溶液中含有0.2 mol KNO3、0.4 mol Cu(NO3)2和0.4 mol KCl。当有0.3 mol Cu生成时,先后发生反应:
Cu2++2Cl- Cu+Cl2↑①
Cu+Cl2↑①
2Cu2++2H2O 2Cu+O2↑+4H+②
2Cu+O2↑+4H+②
在阳极上先后生成Cl2和O2。n(Cl2)=1/2n(KCl)=(1/2)×0.4 mol=0.2 mol,根据电子守恒有:0.3 mol×2=0.2 mol×2+4n(O2),解得n(O2)=0.05 mol,所以阳极共产生气体体积为:(0.2 mol+0.05 mol )×22.4 L·mol-1=5.6 L。
考点:本题考查电解的计算。

练习册系列答案
相关题目
某原电池的结构如右图所示,下列有关该原电池的说法中不正确盼是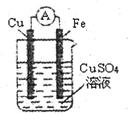
| A.铁棒为正极 |
| B.铜棒发生还原反应 |
| C.电流从铜棒经外电路流向铁棒 |
| D.铁棒质量减轻 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2作溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法不正确的是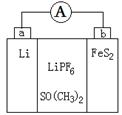
| A.该装置将化学能转化为电能 |
| B.电子移动方向是由a极到b极 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是
| A.通入CH3OH的电极为负极 |
| B.随着放电的进行,负极附近pH上升 |
| C.每消耗1molCH3OH可以向外电路提供6mol e- |
| D.通入O2的一极电极反应为 4H2O+2O2-8e-=8OH- |
关于下列各装置图的叙述中,不正确的是 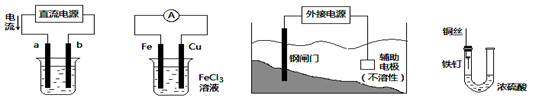
① ② ③ ④
| A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
| C.为防止钢闸门被腐蚀,装置③中钢闸门应与外接电源的负极相连 |
| D.装置④中的铁钉几乎没被腐蚀 |
关于下列装置说法正确的是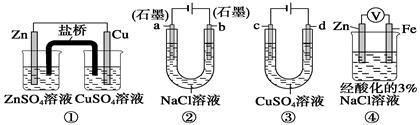
| A.装置①中,盐桥中的K+移向ZnSO4溶液 |
| B.装置②工作一段时间后,a极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,脱氧的同时可降低温度,延长糕点保质期 |
| B.脱氧过程中铁做原电池正极,电极反应为:Fe—2e— = Fe2+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O + O2 + 4e— = 4OH— |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
铅蓄电池是一种用途极广的二次电池,其电池反应为:
下列说法不正确的是
| A.放电时,负极质量增加 |
| B.充电时,应将外接直流电源的正极与蓄电池的铅电极相接 |
C.放电时,正极反应为: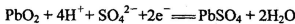 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4 |