题目内容
【题目】氮的氧化物是主要的空气污染物,目前消除氯氧化物污染的方法有多种。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ)
①写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程式:________
②为研究不同条件下对上述反应( Ⅱ )的影响,在恒温条件下,向2 L 的恒容密闭容器中加入0.2mol CH4和0.4mol NO2,10min反应(Ⅱ)达到平衡,测得l0min内v(NO)=5×10-3mol/(L·min),则平衡后n(CH4)=___mol,NO2的转化率a1=_________.其它条件不变,反应在恒压条件下进行,平衡时NO2的转化率a2____a1(填“大于” 小于”或“ 等于” )。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下
时间 浓度(mol/L) 物质 | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据 是_________
A.容器内CO2的浓度保持不变
B.v正(N2)= v正(NO)
C.混合气体的平均相对分子质量保持不变
D.混合气体的密度保持不变
E.容器内压强保持不变
②在T℃时.该反应的平衡常数为_______ (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是________。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2, 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.如图表示在其他条件不变时,反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
N2(g)+2CO2(g) 中NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①该反应的ΔH____0(填“>”或“<”)。
②若催化剂的表面积S1 >S2,在图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。____
【答案】 CH4(g)+2NO2=N2(g)+CO2(g)+2H2O(g) ΔH=-955kJ/mol 0.175 25% 大于 BE 0.56 减小CO,的浓度 ① < 如图所示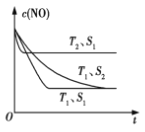
【解析】试题分析:(1) ① 根据盖斯定律写CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式;② 根据v(NO)=5×10-3mol/(L·min)计算10min内c(NO)的变化量,利用“三段式”计算平衡后n(CH4)、NO2的转化率a1;CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,正反应体积增大,其它条件不变,反应在恒压条件下进行,相当于减压,平衡正向移动。(2)①根据平衡标志分析;②根据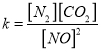 计算在T℃时该反应的平衡常数;③根据表格数据,40min时NO、CO2的浓度减小,N2的浓度增大分析;(3)①根据“先拐先平”,T2温度大于T1,升高温度NO的百分含量增大,平衡逆向移动;②催化剂表面积越大,反应速率越快,但平衡不移动,NO的百分含量不变;
计算在T℃时该反应的平衡常数;③根据表格数据,40min时NO、CO2的浓度减小,N2的浓度增大分析;(3)①根据“先拐先平”,T2温度大于T1,升高温度NO的百分含量增大,平衡逆向移动;②催化剂表面积越大,反应速率越快,但平衡不移动,NO的百分含量不变;
解析:(1) ① CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1(Ⅰ)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1(Ⅱ)
H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1(Ⅲ),根据盖斯定律Ⅰ×![]() +(Ⅱ)×
+(Ⅱ)×![]() -Ⅲ×2得CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2=N2(g)+CO2(g) +2H2O (l) ΔH=-955kJ/mol;② v(NO)=5×10-3mol/(L·min),10min内c(NO)的变化量是0.05 mol/L ,
-Ⅲ×2得CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2=N2(g)+CO2(g) +2H2O (l) ΔH=-955kJ/mol;② v(NO)=5×10-3mol/(L·min),10min内c(NO)的变化量是0.05 mol/L ,

则平衡时n(CH4)=0.0875 mol/L×2L=0.175mol; NO2的转化率a1=![]() ;CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,正反应体积增大,其它条件不变,反应在恒压条件下进行,相当于减压,平衡正向移动,所以平衡时NO2的转化率a2大于a1。
;CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,正反应体积增大,其它条件不变,反应在恒压条件下进行,相当于减压,平衡正向移动,所以平衡时NO2的转化率a2大于a1。
(2)①A.根据化学平衡定义,容器内CO2的浓度保持不变,一定平衡;B.任意时刻都满足 v正(N2)= v正(NO),所以v正(N2)= v正(NO)时不一定平衡;C. m不变,总物质的量n是变量,根据![]() ,混合气体的平均相对分子质量是变量,则平均相对分子质量保持不变一定平衡;D.气体质量不变、容器体积不变,根据
,混合气体的平均相对分子质量是变量,则平均相对分子质量保持不变一定平衡;D.气体质量不变、容器体积不变,根据![]() ,密度是定量,所以混合气体的密度保持不变不一定平衡;E.气体物质的量是变量,容器体积不变,所以压强是变量,容器内压强保持不变一定平衡;故选BE。
,密度是定量,所以混合气体的密度保持不变不一定平衡;E.气体物质的量是变量,容器体积不变,所以压强是变量,容器内压强保持不变一定平衡;故选BE。
②根据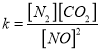 ,在T℃时该反应的平衡常数
,在T℃时该反应的平衡常数![]() 0.56 ;③根据表格数据,40min时NO、CO2的浓度减小,N2的浓度增大分析,所以在30min改变的条件是减小CO2的浓度;(3)①根据“先拐先平”,T2温度大于T1,升高温度NO的百分含量增大,平衡逆向移动,反应的ΔH<0;②催化剂表面积越大,反应速率越快,但平衡不移动,NO的百分含量不变,所以变化曲线是
0.56 ;③根据表格数据,40min时NO、CO2的浓度减小,N2的浓度增大分析,所以在30min改变的条件是减小CO2的浓度;(3)①根据“先拐先平”,T2温度大于T1,升高温度NO的百分含量增大,平衡逆向移动,反应的ΔH<0;②催化剂表面积越大,反应速率越快,但平衡不移动,NO的百分含量不变,所以变化曲线是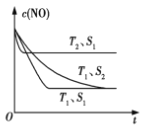 。
。


