题目内容
已知86Rn(氡)基态原子的电子排布式为1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6,88Ra基态原子的电子排布式可简化为[Rn]7s2。114号元素是化学家和物理学家很感兴趣的尚未发现的元素。
(1)用简化的形式写出114号元素基态原子的电子排布式: ______________
________________________________________________________________。
(2)根据原子核外电子排布的特征,判断114号元素在周期表中的第________周期________族。
(3)根据114号元素在周期表中的位置判断,它最不应具有的性质是________。
第一电离能大于88Ra
②鲍林电负性大于3.0
③最高化合价为+4价,也可有+2价
④最高价氧化物的对应水化物显碱性
(1)[Rn]5f146d107s27p2 (2)7 ⅣA (3)②
【解析】(1)设114号元素为x。x元素原子比86Rn原子多28个电子。根据基
态原子的核外电子排布规则,x元素基态原子电子排布式的简化式应为
[Rn]5f146d107s27p2。
(2)由[Rn]5f146d107s27p2可知,x元素原子的价电子排布式为7s27p2。所以该
元素在周期表的第7周期、ⅣA族。
(3)88Ra在第7周期、ⅡA族,x元素在第7周期、ⅣA族,所以x元素原子
的第一电离能大于88Ra。第6周期、ⅣA族元素铅是金属元素,位于第7
周期、ⅣA族的x元素的金属性比铅还要强,所以x元素的鲍林电负性应小
于2.0。铅元素的化合价有+4价和+2价,与铅同族的x元素的化合价也应
有+4价和+2价。一般来说,金属元素最高价氧化物对应水化物显碱性。

 津桥教育计算小状元系列答案
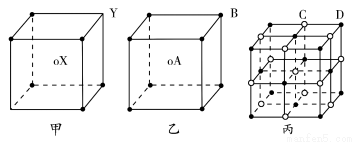
津桥教育计算小状元系列答案下图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )。
|
|
|
|
X |
|
|
|
W | Y |
| R |
|
| Z |
|
A.W、R元素单质分子内的化学键都是非极性键
B.X、Z元素都能够形成双原子分子
C.键能W—H>Y—H,键的极性Y—H>W—H
D.键长X—H<W—H,键能X—H<W—H
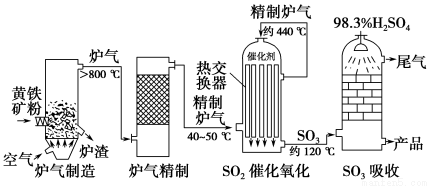
下表列出了3种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
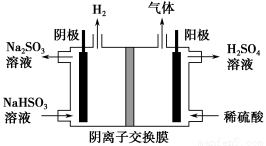
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:
2NH3+SO2+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3
能提高燃煤烟气中SO2去除率的措施有________(填字母)。
A.增大氨水浓度
B.升高反应温度
C.使燃煤烟气与氨水充分接触
D.通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是____________(用离子方程式表示)。
(2)方法Ⅱ中主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=8.0 kJ·mol-1
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=90.4 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为________。
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如下图所示。阳极区放出气体的成分为________(填化学式)。