题目内容
【题目】下列说法中,正确的是![]()
![]() 明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
![]() 氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
![]() 氨常用作制冷剂,是因为其沸点极低,很容易液化
氨常用作制冷剂,是因为其沸点极低,很容易液化
![]() 硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
![]() 通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
![]() 铝粉和氧化镁粉末混合,高温能发生铝热反应
铝粉和氧化镁粉末混合,高温能发生铝热反应
![]() 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
![]() 可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性
![]() 同主族元素的简单阴离子还原性越强,水解程度越大
同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝.
A.3句B.4句C.5句D.6句
【答案】B
【解析】
![]() 明矾溶于水,电离产生的铝离子水解生成氢氧化铝胶体具有吸附性,可以净水,但是不具有氧化性,所以不能杀菌,碳酸钡与盐酸反应生成氯化钡,钡离子为重金属离子,有毒,故错误;
明矾溶于水,电离产生的铝离子水解生成氢氧化铝胶体具有吸附性,可以净水,但是不具有氧化性,所以不能杀菌,碳酸钡与盐酸反应生成氯化钡,钡离子为重金属离子,有毒,故错误;
![]() 二氧化氮、碳氢化合物是形成光化学烟雾的主要污染物,故正确;
二氧化氮、碳氢化合物是形成光化学烟雾的主要污染物,故正确;
![]() 氨常用作制冷剂,是因为其沸点高,很容易液化,故错误;
氨常用作制冷剂,是因为其沸点高,很容易液化,故错误;
![]() 硅在元素周期表种处于金属与非金属的过渡位置,晶体硅是良好的半导体材料,正是由于晶体硅的这一性质以及制备它的原料极其丰富,从20世纪中叶开始,硅成为了信息技术的关键材料,故正确;
硅在元素周期表种处于金属与非金属的过渡位置,晶体硅是良好的半导体材料,正是由于晶体硅的这一性质以及制备它的原料极其丰富,从20世纪中叶开始,硅成为了信息技术的关键材料,故正确;
![]() 四氯化硅容易吸收空气中水蒸气生成原硅酸固体颗粒和盐酸液滴,该反应不属于水解,故错误;
四氯化硅容易吸收空气中水蒸气生成原硅酸固体颗粒和盐酸液滴,该反应不属于水解,故错误;
![]() 胶体吸附带电粒子形成带电胶粒,在外加电场的作用下发生定向移动,故错误;
胶体吸附带电粒子形成带电胶粒,在外加电场的作用下发生定向移动,故错误;
![]() 镁的还原性强于铝,不能通过铝热反应制取镁,故错误;
镁的还原性强于铝,不能通过铝热反应制取镁,故错误;
![]() 二氧化硅与强碱反应,可导致光导纤维断路,故正确;
二氧化硅与强碱反应,可导致光导纤维断路,故正确;
![]() 盐酸不是含氧酸,不能比较氯元素的非金属性强弱,故错误;
盐酸不是含氧酸,不能比较氯元素的非金属性强弱,故错误;
![]() 水解程度强弱与还原性无关,与酸性强弱有关,例如碘离子还原性很强,但是不水解,故错误;
水解程度强弱与还原性无关,与酸性强弱有关,例如碘离子还原性很强,但是不水解,故错误;
![]() 氧化铝的熔点很高,所以
氧化铝的熔点很高,所以![]() 在工业上用于制作耐高温材料,铝是活泼金属,活泼金属的冶炼用电解法,所以用电解法冶炼铝金属,故正确;
在工业上用于制作耐高温材料,铝是活泼金属,活泼金属的冶炼用电解法,所以用电解法冶炼铝金属,故正确;
故正确的说法有:![]() ,
,
故选:B.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
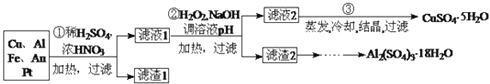
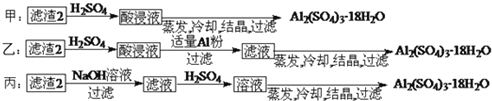
小学生10分钟应用题系列答案【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
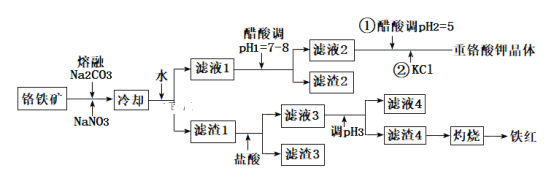
已知:Ⅰ.2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
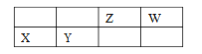
Ⅱ.常见离子开始生成沉淀和沉淀完全的pH值如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
(1)铬铁矿反应前需要进行粉碎,目的是________。
(2)熔融Na2CO3条件下主要反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。该反应中的氧化产物为___________、___________。该条件下还可以得到的副产物为NaAlO2和Na2SiO3,写出生成Na2SiO3的化学方程式为__________。
(3)滤渣2的主要成分为____________;滤渣4的主要成分为___________。
(4)调节pH3的合适试剂为_______________;调节pH3的范围为____________。
(5)用醋酸调节pH2=5的目的为________________。
(6)检验滤液4中Fe3+是否沉淀完全的方法是___________________________。