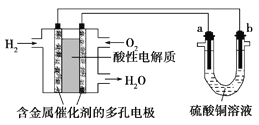
题目内容
【题目】为了制备氯气,某同学查阅资料发现实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)请用双线桥法对该反应进行标注________________。
(2)写出该反应的离子方程式________________。
(3)该反应中,氧化剂和还原剂之比是________________。
【答案】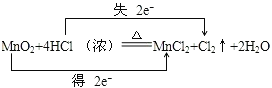 MnO2 + 4H++ 2Cl-
MnO2 + 4H++ 2Cl- ![]() Mn2++Cl2↑ +2H2O 1:2
Mn2++Cl2↑ +2H2O 1:2
【解析】
(1)反应MnO2+4HCl═MnCl2+Cl2+2H2O中,Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,MnCl2为还原产物,氧化剂和还原剂得失电子数目相等,由元素化合价的变化可知转移的电子数目为2,用“双线桥法”表示氧化还原反应中电子转移情况为: ,
,
故答案为:  。
。
(2)实验室用二氧化锰跟浓盐酸加热反应制取氯气,生成氯化锰、氯气和水,反应的离子方程式为: MnO2 + 4H++ 2Cl- ![]() Mn2++Cl2↑ +2H2O,故答案为:MnO2 + 4H++ 2Cl-
Mn2++Cl2↑ +2H2O,故答案为:MnO2 + 4H++ 2Cl- ![]() Mn2++Cl2↑ +2H2O。
Mn2++Cl2↑ +2H2O。
(3)该反应中化合价的变化为:MnO2→MnCl2,锰元素由+4价→+2价,1mol二氧化锰得2mol电子;HCl→Cl↑,氯元素由-1价→0价,1molHCl失去1mol电子,所以其最小公倍数为2,二氧化锰的计量数为1,作还原剂的HCl的计量数为2,物质的量之比等于计量数之比,所以氧化剂和还原剂的物质的量之比为 1:2,故答案为:1:2。

 阅读快车系列答案
阅读快车系列答案【题目】
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
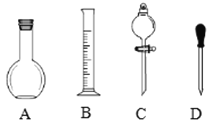
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.