题目内容
【题目】
环己烯是一种重要的有机合成原料。下图是以环己烯为原料进行多种有机物合成的路线:
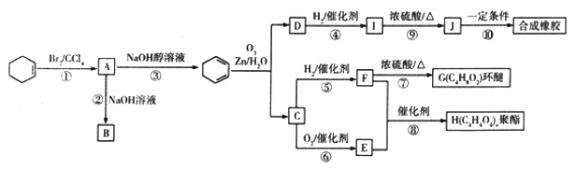
已知以下信息:
(ⅰ)其中F可以作内燃机的抗冻剂;
(ⅱ)J分子中无饱和碳原子;
(ⅲ) Rl—CH=CH—R2 ![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
回答下列问题:
(l)与① 反应类型相同的是________(填序号)。
(2)I生成J的化学方程式为______,反应⑩的生成物“合成橡胶”的结构简式为______。
(3)E的化学名称是___________。
(4)F的结构简式为___________,含有的官能团名称是___________。
(5)能与NaHCO3溶液反应放出CO2的B的同分异构体共有_______种,其中核磁共振氢谱有4 组峰,且峰面积比为1:1:4:6 的是___________(填结构简式)。
(6)参照上述合成路线,以2—戊烯(CH3CH=CHCH2CH3)为原料(其他无机试剂任选),设计制备乙二酸二乙酯的合成路线:___________。
【答案】 ④⑤ HOCH2CH2CH2CH2OH![]() CH2=CHCH=CH2+2H2O
CH2=CHCH=CH2+2H2O ![]() 乙二酸 HOCH2CH2OH 羟基 8
乙二酸 HOCH2CH2OH 羟基 8 

【解析】环己烯和溴分子加成生成A的结构简式为 。A水解生成B的结构简式为
。A水解生成B的结构简式为 ,A发生消去反应生成1,3-己二烯,1,3-己二烯发生已知信息(ⅲ)的反应生成OH-CHO和OHC-CH2CH2-CHO。F可以作内燃机的抗冻剂,F是乙二醇,即C和氢气加成生成F;C继续被氧化生成E是乙二酸,E和F发生缩聚反应生成聚酯H的结构简式为
,A发生消去反应生成1,3-己二烯,1,3-己二烯发生已知信息(ⅲ)的反应生成OH-CHO和OHC-CH2CH2-CHO。F可以作内燃机的抗冻剂,F是乙二醇,即C和氢气加成生成F;C继续被氧化生成E是乙二酸,E和F发生缩聚反应生成聚酯H的结构简式为 。2分子乙二醇分子分子间脱水反应生成G的结构简式为
。2分子乙二醇分子分子间脱水反应生成G的结构简式为![]() ;D和氢气加成生成I的结构简式为HOCH2CH2CH2CH2OH,I在浓硫酸的作用下发生消去反应生成J,则J的结构简式为CH2=CHCH=CH2。J发生加聚反应生成橡胶的结构简式为
;D和氢气加成生成I的结构简式为HOCH2CH2CH2CH2OH,I在浓硫酸的作用下发生消去反应生成J,则J的结构简式为CH2=CHCH=CH2。J发生加聚反应生成橡胶的结构简式为![]() ;则
;则
(l)①是加成反应,则与①反应类型相同的是④⑤。(2)I生成J的化学方程式为HOCH2CH2CH2CH2OH![]() CH2=CHCH=CH2+2H2O,反应⑩的生成物“合成橡胶”的结构简式为
CH2=CHCH=CH2+2H2O,反应⑩的生成物“合成橡胶”的结构简式为![]() 。(3)E的化学名称是乙二酸。(4)F的结构简式为 HOCH2CH2OH,含有的官能团名称是羟基。(5)能与NaHCO3溶液反应放出CO2,说明含有羧基,即相当于是戊烷分子中的1个氢原子被羧基取代,戊基有8种,则B的同分异构体共有8种,其中核磁共振氢谱有4 组峰,且峰面积比为1:1:4:6 的是
。(3)E的化学名称是乙二酸。(4)F的结构简式为 HOCH2CH2OH,含有的官能团名称是羟基。(5)能与NaHCO3溶液反应放出CO2,说明含有羧基,即相当于是戊烷分子中的1个氢原子被羧基取代,戊基有8种,则B的同分异构体共有8种,其中核磁共振氢谱有4 组峰,且峰面积比为1:1:4:6 的是 。(6)根据已知信息结合逆推法可知以2-戊烯(CH3CH=CHCH2CH3)为原料(其他无机试剂任选)制备乙二酸二乙酯的合成路线为
。(6)根据已知信息结合逆推法可知以2-戊烯(CH3CH=CHCH2CH3)为原料(其他无机试剂任选)制备乙二酸二乙酯的合成路线为 。
。

【题目】下列陈述I、II均正确并且有因果关系的是( )
选项 | 陈述I | 陈述II |
A | Fe2O3是红棕色粉末 | Fe2O3常做红色涂料 |
B | SiO2是两性氧化物 | SiO2可和HF反应 |
C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
D | SO2有漂白性 | SO2可使溴水褪色 |
A. A B. B C. C D. D