题目内容
【题目】设NA为阿伏加德罗常数值。下列说法正确的是( )
A.30g醋酸和葡萄糖的混合物中,碳原子数的数目为NA
B.标准状况下,2.24 L CHCl3含有的共价键数为 0.4NA
C.常温下,2.8 g C2H4与CO的混合气体所含碳原数为 0.3NA
D.0.1mol/L Na2S 溶液中,S2- 、HS- 、H2S的数目共为0.1NA
【答案】A
【解析】
A.醋酸的分子式为C2H4O2,葡萄糖的分子式为C6H12O6,二者最简式相同均为CH2O,质量一定的情况下,无论何种比例混合,含有的各类原子个数均为定值;因此,30g的混合物中,C原子的数目即NA,A项正确;
B.CHCl3在标况下不为气体,不能用公式![]() 计算,B项错误;
计算,B项错误;
C.C2H4和CO摩尔质量均为28g/mol,但由于每个分子中C原子的个数不相同,所以混合时比例不同,混合物中C的个数就不相同,C项错误;
D.由于不知道溶液的体积,所以溶液中各类粒子的数目无法计算,D项错误;
答案选A。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是( )
实验 序号 | 实验温度T/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间t/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 6 | 0.1 | 0 | 6 |
B | 293 | 4 | 0.02 | 4 | 0.1 | V1 | 8 |
C | T1 | 4 | 0.02 | 6 | 0.1 | 0 | 5 |
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=1.6×10-3molL-1s-1
C.实验A和B是探究
D.实验A和C是探究温度对反应速率的影响,则T1>293
【题目】钠、铝是两种重要的金属,其单质及化合物在人们的日常生活、生产及科学研究中具有广泛的用途。回答下列问题:
(1)基态铝原子的电子排布图是____________________。
(2)与Al3+具有相同的电子层结构的简单阴离子有__________(填离子符号),其中形成这些阴离子的元素中,电负性最强的是__________(填元素符号,下同),第一电离能最小的是__________。
(3)Al、Cl的电负性如下表:
元素 | Al | Cl |
电负性 | 1.5 | 3.0 |
则AlCl3为________晶体(填晶体类型);AlCl3升华后蒸气的相对分子质量约为267,则该蒸气分子的结构式是____________(标明配位键)。
(4)氢化铝钠(NaAlH4)是重要的有机合成中还原剂。
①![]() 的空间构型为____________。
的空间构型为____________。
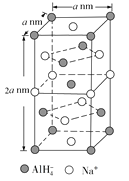
②NaAlH4的晶胞如下图所示,与Na+紧邻且等距的![]() 有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。