题目内容
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是( )
实验 序号 | 实验温度T/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间t/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 6 | 0.1 | 0 | 6 |
B | 293 | 4 | 0.02 | 4 | 0.1 | V1 | 8 |
C | T1 | 4 | 0.02 | 6 | 0.1 | 0 | 5 |
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=1.6×10-3molL-1s-1
C.实验A和B是探究
D.实验A和C是探究温度对反应速率的影响,则T1>293
【答案】C
【解析】
A.溶液颜色褪至无色时所需时间t,即为从溶液混合到KMnO4颜色褪去的时间,故A正确;
B.利用实验C中数据计算,用KMnO4的浓度变化表示的化学反应速率v(KMnO4)=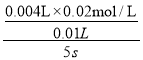 =1.6×10-3molL-1s-1,故B正确;
=1.6×10-3molL-1s-1,故B正确;
C.实验A和B是在相同温度和相同KMnO4的浓度下,探究H2C2O4浓度对反应速率的影响,则V1=2,故C错误;
D.实验A和C是在KMnO4和H2C2O4浓度相同的条件下,探究温度对反应速率的影响,C的反应速率快,则T1>293,故D正确;
故答案为C。

练习册系列答案
相关题目