题目内容
【题目】通常条件下,下列物质能用化合反应制得的是
A.![]() B.
B.![]() C.
C.![]() D.CuS
D.CuS
【答案】B
【解析】
两种或两种以上的物质反应生成一种物质的反应为化合反应。
A.可通过可溶性的铝盐和碱发生复分解反应生成氢氧化铝;
B.氢氧化亚铁和氧气、水反应生成氢氧化铁;
C.利用强酸制取弱酸的原理制备硅酸;
D.硫和铜反应生成硫化亚铜。
![]() 制备氢氧化铝,可用铝盐和氨水反应,离子反应为:
制备氢氧化铝,可用铝盐和氨水反应,离子反应为:![]() ,属于复分解反应,无法以化合反应制取,故A错误;
,属于复分解反应,无法以化合反应制取,故A错误;
B.反应方程式为:![]() ,B可以实现,故B正确;
,B可以实现,故B正确;
C.制备硅酸的反应为:![]() ,是两种化合物相互交换成分生成另外两种化合物的反应,故为复分解反应,故C错误;
,是两种化合物相互交换成分生成另外两种化合物的反应,故为复分解反应,故C错误;
D.硫为弱氧化剂,则铜粉和硫粉混合加热制备硫化亚铜,无法通过化合反应制取硫化铜,故D错误;
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
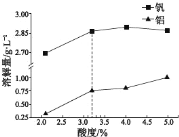
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)






