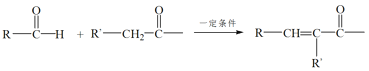题目内容
【题目】对下列流程有关判断正确的是
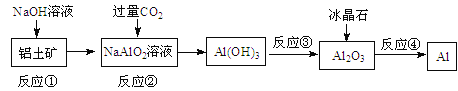
A.流程中涉及的反应均为非氧化还原反应
B.反应②产生的阴离子主要为CO32-
C.实验室中完成反应③应在蒸发皿中进行
D.反应④的条件是电解熔融
【答案】D
【解析】
向铝土矿中加入NaOH溶液,会发生反应:Al2O3+2NaOH=2NaAlO2+H2O,该反应为非氧化还原反应,故A错误;
向NaAlO2溶液中通入过量的CO2,发生反应:NaAlO2+CO2+ 2H2O=Al(OH)3↓ +NaHCO3,由于CO2过量,得到的是HCO3-,故B错误;
Al(OH)3灼烧发生分解反应产生Al2O3和水,该反应应该在坩埚中进行,故C错误;
电解熔融的Al2O3制取 金属Al。由于Al2O3熔点高达2000多℃,为了降低物质的熔点,加入助溶剂冰晶石,故D正确;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目