题目内容
【题目】炼铁厂的废渣铁矾渣主要含有K2Fe6(SO4)4(OH)12 、ZnO![]() Fe2O3 及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:
Fe2O3 及少量的CaO、MgO、SiO2 ,等等。可利用废渣铁矾渣制备复合镍锌铁氧体 (NiZnFe4O8.具体制备流程如下图所示:

(1)试剂1是过量的______。
(2)试剂2为过量的铁粉,加入后可以观察的现象有 ______________________。
(3)NH4F溶液不能放入玻璃器皿中保存,理由是_____________________________(用离子方程式表示)。已知:25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol L-1,此时Ca2+是否也完全沉淀?写出具体的分析过程:______(若溶液中某离子浓度小于1.0×10-5mol L-1时,说明该离子已沉淀完全)。
(4)在Fe2+、Ni2+、Zn2+共沉淀过程中,若以Me代表Fe、Ni、Zn元素,则生成MeCO32Me(OH)2H2O沉淀的化学方程式为 ________________________________.
(5)按照上述流程,一座10万吨规模的炼铁厂每年产生铁矶渣约5万吨,Fe3+含量为44.8%,理论上每年至少可制备复合镍锌铁氧体(NiZnFe4O8 ,M=476 g mol -1 )__________万吨。
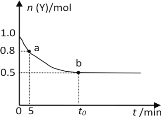
(6)滤液Ⅱ中加入的ZnSO4溶液,低温烘干后可得到皓矾(ZnSO4 7H2O) 取28.70 g皓矾加热至不同温度,剩余固体的质量变化如图所示:

①100 °C时所得固体的化学式__________ 。
②680 °C时所得固休的化学式为____
【答案】稀H2SO4(或稀硫酸) 溶液有棕黄色转变为浅绿色,同时有气泡产生 NH4+ +F-+H2O=NH3·H2O+HF、SiO2+ 4HF = SiF4 + 2H2O 已知25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol L-1,则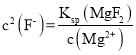 =4×10-9,故
=4×10-9,故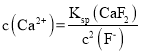 =0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀; 3MeSO4+6NH4HCO3=MeCO32Me(OH)2H2O+5CO2↑ 7.6 ZnSO4 H2O Zn3O(SO4)2
=0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀; 3MeSO4+6NH4HCO3=MeCO32Me(OH)2H2O+5CO2↑ 7.6 ZnSO4 H2O Zn3O(SO4)2
【解析】
(1)废渣铁矾渣主要含有K2Fe6(SO4)4(OH)12,在除杂制备过程中避免引入更多的离子,应该使用稀硫酸进行酸浸。
答案为:稀H2SO4(或稀硫酸)
(2)酸浸后的溶液含有三价铁离子的棕黄色溶液,加入过量铁粉,使三价铁离子转化为二价铁离子,溶液有棕黄色转变为浅绿色。酸浸时硫酸过量,加入铁粉有气泡产生。
答案为:溶液有棕黄色转变为浅绿色,同时有气泡产生。
(3)NH4F会水解生成氨水与HF,HF会腐蚀玻璃瓶,离子反应方程式为:NH4+ +F-+H2O=NH3·H2O+HF、SiO2+ 4HF = SiF4 + 2H2O;已知25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol L-1,则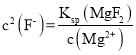 =4×10-9,故
=4×10-9,故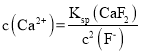 =0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀;
=0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀;
答案为:NH4+ +F-+H2O=NH3·H2O+HF、SiO2+ 4HF = SiF4 + 2H2O;已知25 °C时,Ksp(CaF2)=2.7×10-11、,Ksp(MgF2)=6.4×10-19。加入NH4F溶液沉淀后,c(Mg2+) = 1. 6×10-10mol L-1,则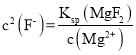 =4×10-9,故
=4×10-9,故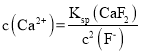 =0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀;
=0.675×10-2 mol L-1>1.0×10-5mol L-1,故Ca2+未完全沉淀;
(4)根据流程Fe、Ni、Zn元素来的硫酸盐与NH4HCO3生成MeCO32Me(OH)2H2O沉淀和二氧化碳反应方程式为:3MeSO4+6NH4HCO3=MeCO32Me(OH)2H2O+5CO2↑;
故答案为: 3MeSO4+6NH4HCO3=MeCO32Me(OH)2H2O+5CO2↑;
(5)黄钾铁矾渣约5万吨,Fe3+含量为5万吨×48%=2.4万吨,根据2Fe3++Fe=3Fe2+,
则Fe2+含量为2.4万吨×![]() =3.6万吨,设制得的NiZnFe4O8有x万吨,根据元素守恒,有
=3.6万吨,设制得的NiZnFe4O8有x万吨,根据元素守恒,有![]() =3.6,解得x=7.6万吨。
=3.6,解得x=7.6万吨。
答案为:7.6
(6)皓矾(ZnSO4 7H2O)受热易分解,在不同的温度下分解可生成ZnSO4 H2O或ZnSO4或ZnO或Zn3O(SO4)2产物不同;28.70 g皓矾的物质的量为:
![]() , 不论分解产物是什么,根据锌元素守恒,物质的量为
, 不论分解产物是什么,根据锌元素守恒,物质的量为![]() ,因此生成
,因此生成![]() ZnSO4 H2O的质量为17.90g;生成
ZnSO4 H2O的质量为17.90g;生成![]() ZnSO4的质量为16.10g;生成
ZnSO4的质量为16.10g;生成![]() Zn3O(SO4)2的质量为13.34g;生成
Zn3O(SO4)2的质量为13.34g;生成![]() ZnO的质量为8.10g;
ZnO的质量为8.10g;
根据上述
① 100 °C时所得固体的为17.90g,生成的固体为ZnSO4 H2O。
② 680 °C时所得固休的质量为13.43g化学式为Zn3O(SO4)2。
答案为:ZnSO4 H2O;Zn3O(SO4)2

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案