题目内容
11.在不同温度下,向VL密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(8)=N2(g)+CO2(g)△H=-Qkj•mol-1(Q>0),达到平衡时的数据如下:| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.15 | |
| T2 | 0.375 |
| A. | 由上述信息可推知:T1>T2 | |
| B. | T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)增大 | |
| C. | T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大 | |
| D. | T1℃时,该反应的平衡常数$K=\frac{9}{16}$ |
分析 A、根据T2时活性炭的平衡物质的量计算出二氧化碳平衡物质的量与T1℃时二氧化碳平衡物质的量比较,平衡温度对化学平衡的影响;
B、反应2NO(g)+C(s)═N2(g)+CO2是气体体积不变的反应,平衡不受压强的影响;
C、反应2NO(g)+C(s)═N2(g)+CO2是气体体积不变的反应,若开始时反应物的用量均减小一半,相当于压强减小,平衡不受压强的影响;
D、根据反应2NO(g)+C(s)═N2(g)+CO2(g)平衡常数K=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{2}(NO)}$计算判断.
解答 解:A、温度T2时,活性炭的平衡物质的量为0.375mol,则消耗的n(活性炭)=0.5mol-0.375mol=0.125mol,故消耗的n(NO)=0.25mol,平衡时n(NO)=0.5mol-0.25mol=0.25mol,生成的n(N2)=0.125mol,生成的n(CO2)=0.125mol,温度T1时,生成的n(CO2)=0.15mol,反应2NO(g)+C(s)═N2(g)+CO2(g)△H=-213.5kJ/mol,正反应为放热反应,升温平衡逆向移动,所以T1<T2,故A错误;
B、反应2NO(g)+C(s)═N2(g)+CO2(g)是一个气体体积不变的反应,平衡后再缩小容器的体积,压强增大,但平衡不移动,故c (N2):c (NO)不变,故B错误;
C、反应2NO(g)+C(s)═N2(g)+CO2(g)是一个气体体积不变的反应,开始时反应物的用量均减小一半,压强减小,但平衡不移动,平衡后NO的转化率不变,故C错误;
D、2NO(g)+C(s)═N2(g)+CO2(g)
起始量(mol) 0.5 0.5 0 0
变化量(mol) 0.3 0.15 0.15 0.15
平衡量(mol) 0.2 0.35 0.15 0.15
温度T1,平衡时c(NO)=$\frac{0.2mol}{VL}$=$\frac{0.2}{V}$mol/L,c(N2)=$\frac{0.15}{V}$mol/L,n(CO2)=$\frac{0.15}{V}$mol/L,平衡常数K=$\frac{c(C{O}_{2})c({N}_{2})}{{c}^{2}(NO)}$=$\frac{\frac{0.15}{V}×\frac{0.15}{V}}{(\frac{0.2}{V})^{2}}$=$\frac{9}{16}$,故D正确;
故选:D.
点评 本题考查了化学平衡影响因素和化学平衡常数的计算问题,难度不大,注意反应2NO(g)+C(s)═N2(g)+CO2是气体体积不变的反应,平衡不受压强的影响.

 应用题作业本系列答案
应用题作业本系列答案| A. | 自来水中通入少量Cl2进行消毒杀菌 | |
| B. | 用SO2漂白食品 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢 | |
| D. | 用小苏打(NaHCO3)发酵面团制作馒头 |
| A. | 乙醇与金属钠反应 | |
| B. | 乙醇在铜丝存在条件下发生催化氧化 | |
| C. | 乙醇与乙酸发生的酯化反应 | |
| D. | 乙醇在浓硫酸存在下发生消去反应 |
| A. | 离子半径:X+>Y- | |
| B. | Z元素的最高正化合价与最低负化合价代数和为4 | |
| C. | X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 | |
| D. | Y的氢化物中存在离子键 |
| A. | 木炭与浓硫酸共热 | B. | Na2O2与足量的稀硫酸反应 | ||
| C. | 足量的钢与一定量的浓硫酸反应 | D. | 电解饱和食盐水 |
| A. | 若混合后溶液pH=7,则c(NH4+)=c(Cl-) | |
| B. | 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(NH3•H2O),则可推出a=1 |
| A. | 它是一种新元素 | B. | 2645FeFe与2656Fe互为同素异形体 | ||
| C. | 它是一种新原子 | D. | 这种铁原子的中子数是26 |
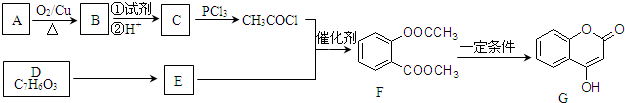
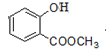 .
.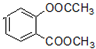 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+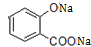 +H2O.
+H2O.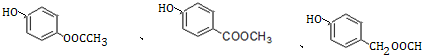 .
.