题目内容
两份等质量的铜片,一份直接与足量的质量分数为98.0%的浓硫酸(密度为1.84 g·cm-3)反应,另一份先制成氧化铜,再与足量的稀硫酸反应。结果两种方法得到的硫酸铜质量相等,消耗两酸的体积也相等。求浓、稀硫酸的物质的量浓度。?
c(浓H2SO4)="18.4" mol·L-1,c(稀H2SO4)="9.20" mol·L-1
本题有多种解法,但须先求出浓H2SO4的物质的量浓度。为方便计算,设有浓H2SO4 1 L,则浓H2SO4的物质的量浓度为:
?c(浓H2SO4)=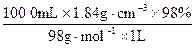 ="18.4" mol·L-1
="18.4" mol·L-1
下面是计算稀H2SO4物质的量浓度的两种方法。
方法1(一般解法):先求浓H2SO4的体积:
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
1.00 mol Cu消耗H2SO4的物质的量为2.00 mol,其质量为:
?m(H2SO4)="98" g· mol-1×2.00 mol="196" g
则1.00 mol Cu消耗浓H2SO4的体积为:
?V(浓H2SO4)=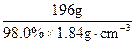 ="108.7" mL
="108.7" mL
再求稀H2SO4的浓度:
2Cu+O2 2CuO
2CuO
CuO+H2SO4(稀)====CuSO4+H2O
Cu与H2SO4(稀)的关系式为:
Cu~H2SO4
相当于1.00 mol Cu消耗1.00 mol H2SO4(稀),由于所耗浓、稀H2SO4的体积相等,所以稀H2SO4的浓度为:
?c(稀H2SO4)=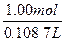 ="9.20" mol·L-1
="9.20" mol·L-1
方法2(巧解法):比较两种方法,可知1.00 mol Cu消耗2.00 mol浓H2SO4,1.00 mol Cu消耗1.00 mol稀H2SO4。由于所耗浓、稀H2SO4的体积相等,所以
?c(稀H2SO4)=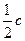 (浓H2SO4)=
(浓H2SO4)=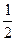 ×18.4 mol·L-1="9.20" mol·L-1。
×18.4 mol·L-1="9.20" mol·L-1。
?c(浓H2SO4)=
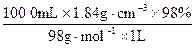 ="18.4" mol·L-1
="18.4" mol·L-1下面是计算稀H2SO4物质的量浓度的两种方法。
方法1(一般解法):先求浓H2SO4的体积:
Cu+2H2SO4(浓)====CuSO4+SO2↑+2H2O
1.00 mol Cu消耗H2SO4的物质的量为2.00 mol,其质量为:
?m(H2SO4)="98" g· mol-1×2.00 mol="196" g
则1.00 mol Cu消耗浓H2SO4的体积为:
?V(浓H2SO4)=
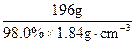 ="108.7" mL
="108.7" mL再求稀H2SO4的浓度:
2Cu+O2
 2CuO
2CuOCuO+H2SO4(稀)====CuSO4+H2O
Cu与H2SO4(稀)的关系式为:
Cu~H2SO4
相当于1.00 mol Cu消耗1.00 mol H2SO4(稀),由于所耗浓、稀H2SO4的体积相等,所以稀H2SO4的浓度为:
?c(稀H2SO4)=
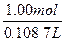 ="9.20" mol·L-1
="9.20" mol·L-1方法2(巧解法):比较两种方法,可知1.00 mol Cu消耗2.00 mol浓H2SO4,1.00 mol Cu消耗1.00 mol稀H2SO4。由于所耗浓、稀H2SO4的体积相等,所以
?c(稀H2SO4)=
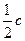 (浓H2SO4)=
(浓H2SO4)=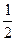 ×18.4 mol·L-1="9.20" mol·L-1。
×18.4 mol·L-1="9.20" mol·L-1。
练习册系列答案
相关题目
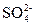
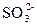
 Fe2(SO4)3+SO2↑+4H2O?
Fe2(SO4)3+SO2↑+4H2O?