题目内容
【题目】根据下列图示所得出的结论正确的是
A. 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
B. 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
D. 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
【答案】A
【解析】
A. Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液中生成硫酸钡沉淀,导电能力减弱,a中硫酸氢钠过量,则溶质为氢氧化钠、硫酸钠,说明a点对用的溶液显碱性,A项正确;
B.该图中反应物能量小于生成物能量,属于吸热反应,B项错误;
C. 由I2+I-I3-中I3-的平衡浓度随温度变化的曲线分析可知,升温平衡逆向进行,平衡常数K(T2)<K(T1),C项错误;
D. 甲基橙的变色范围是3.1-4.4,图象中反应终点的pH不在此范围,不可用甲基橙判断该反应的终点,D项错误;
答案选A。

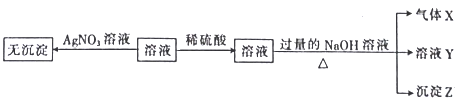
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH |
阴离子 | SiO |
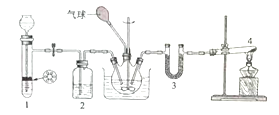
实验I:取少量该溶液进行如图实验。
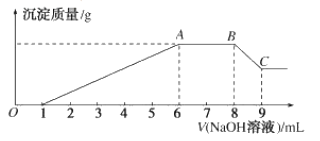
实验II:为了进一步确定该溶液的组成,取200mL原溶液,向该溶液中滴加2molL-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。
回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是___。
(3)写出实验II的图像中BC段对应的离子方程式:___。
(4)A点对应的固体质量为___ g。
(5)该溶液中阴离子的浓度为___ molL-1。
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

![]() 流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:
流程I的另一产物是 ______ ,流程Ⅱ的反应分步进行:![]()

![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为 ______ .
与石灰石发生复分解反应,总反应方程式可表示为 ______ .
Ⅱ![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|
![]() 氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
氨碱法生成纯碱的原料是 ______ ,可循环利用的物质有 ______ .
![]() 饱和NaCl溶液通
饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有: ______ .
的原因有: ______ .
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.

![]() 生产中需向分离出
生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在 ______
,在 ______ ![]() 填温度范围
填温度范围![]() 下析出 ______
下析出 ______ ![]() 填化学式
填化学式![]()