题目内容
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
分析:根据反应前后元素化合价发生变化的反应为氧化还原反应,水中H、O元素的化合价均不变,则水在氧化还原反应中既不作氧化剂又不作还原剂.
解答:解:A、H2O+CaO=Ca(OH)2中,各元素的化合价都没有变化,则不是氧化还原反应,故A错误;
B、反应中F元素的化合价降低,O元素的化合价升高,则属于氧化还原反应,水作还原剂,故B错误;
C、2H2O
O2↑+2H2↑中,H元素的化合价降低,O元素的化合价升高,则水既作氧化剂又作还原剂,故C错误;
D、3NO2+H2O=2HNO3+NO中,N元素的化合价既升高又降低,则属于氧化还原反应,NO2既作氧化剂又作还原剂
,水中H、O元素的化合价都没有变化时,水既不作氧化剂又不作还原剂,故D正确.
故选:D.
B、反应中F元素的化合价降低,O元素的化合价升高,则属于氧化还原反应,水作还原剂,故B错误;
C、2H2O
| ||
D、3NO2+H2O=2HNO3+NO中,N元素的化合价既升高又降低,则属于氧化还原反应,NO2既作氧化剂又作还原剂
,水中H、O元素的化合价都没有变化时,水既不作氧化剂又不作还原剂,故D正确.
故选:D.
点评:本题考查氧化还原反应、氧化剂与还原剂的判断,比较基础,明确元素的化合价来分析氧化还原反应、氧化剂与还原剂.

练习册系列答案
相关题目
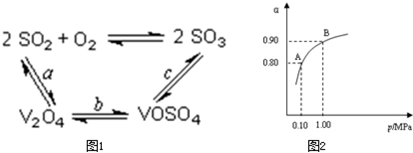
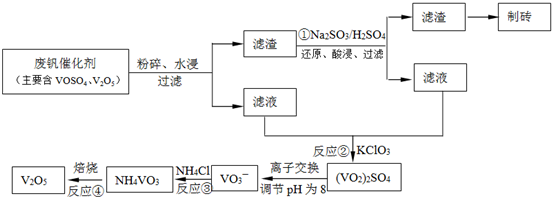
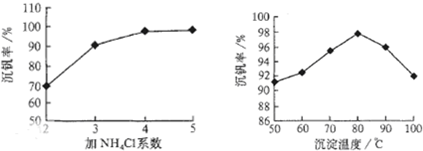
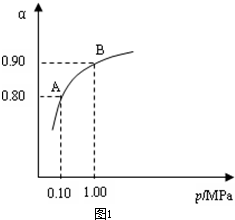 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: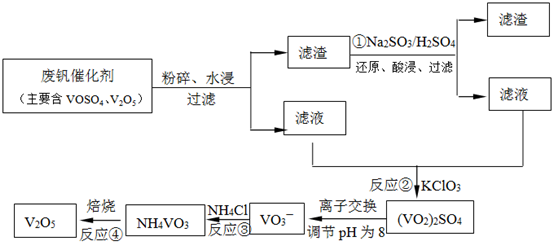
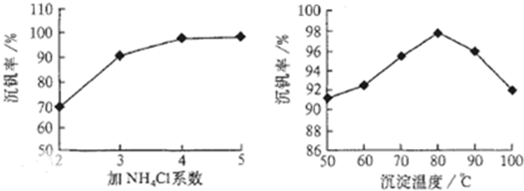






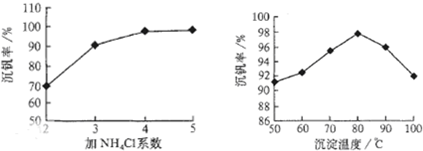
 2SO3(g);△H<0
2SO3(g);△H<0

