题目内容
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列个问题:
(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中a、c二步的化学方程式可表示为:___________________________、________________________。
(2)

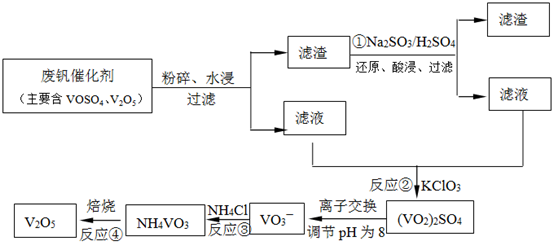
(3)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣。查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如下图。

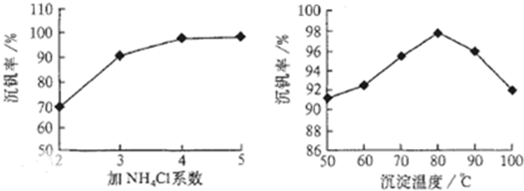
则:反应①②③④中属于氧化还原反应的是____________(填数字序号),反应①的离子方程式为____________________________________。该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵计量数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵计量数和温度:____________、____________。

(1)SO2+V2O5![]() SO3+ V2O4 4VOSO4+O2
SO3+ V2O4 4VOSO4+O2![]() 2V2O5+4SO3
2V2O5+4SO3
(2)
(3)①② V2O5+![]() +4H+
+4H+![]() 2VO2++
2VO2++![]() +2H2O 4 80 ℃
+2H2O 4 80 ℃
解析:(1)V2O5作为催化剂,参与反应但反应前后保持不变,所以最后V2O5必须释放出来,故反应方程式为:SO2+V2O5![]() SO3+V2O4;
SO3+V2O4;
4VOSO4+O2![]() 2V2O5+4SO3
2V2O5+4SO3
(2) 2SO2+O2![]() 2SO3
2SO3
初始的物质的量/mol 2.0 1.0 0
转化的物质的量/mol 1.6 0.8 1.6
平衡时的物质的量/mol 0.4 0.2 1.6
K= =
=
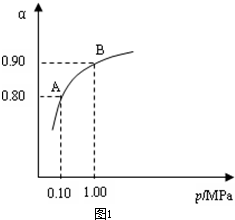
工业生产中要考虑经济效益,使用常压SO2就可以达到很高的转化率,没有必要使用高压。
(3)由两图中数据可看出控制NH4Cl计量数是4,温度是


 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: