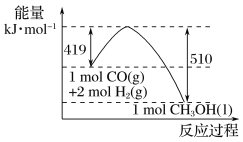
题目内容
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
查阅资料:CuCl22H2O ![]() CuCl2
CuCl2 ![]() CuCl+Cl2;CuCl22H2O
CuCl+Cl2;CuCl22H2O![]() Cu2(OH)2Cl2
Cu2(OH)2Cl2![]() CuO
CuO
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
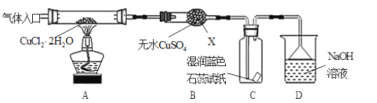
请回答下列问题:
(1)仪器X的名称是___;装置D中倒扣的三角漏斗的作用是_____;
(2)实验操作的先后顺序是a→____→____→____→e (填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____;
(4)装置D中发生的氧化还原反应的离子方程式是_____;
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是____;
②若杂质是CuO,则产生的原因是____。
【答案】球形干燥管 防倒吸 c d b 先逐渐变为红色,后褪色 Cl2+2OH-=Cl-+ClO-+H2O 加热温度不够或加热时间不足 没有在HCl的氛围中加热
【解析】
由题意可知,结晶水合物CuCl·2H2O制备CuCl的过程为先通入HCl,防止没有HCl的情况下加热生成碱式氯化铜,点燃酒精灯加热,熄灭酒精灯,后停止通入HCl,最后用氮气将装置内的HCl和氯气排空进而被尾气装置中的氢氧化钠吸收。
(1)根据仪器X的构造特点知其名称为干燥管,故答案为球形干燥管;装置D中倒扣的三角漏斗,增大了气体与溶液的接触面,增大了吸收效率,又能起到防倒吸作用;
(2)实验中有气体生成,先检验装置的气密性;加热CuCl2·2H2O制备CuCl,为防止生成的CuCl被空气中的氧气氧化和Cu+水解,必须要先通入干燥的HCl气体赶走装置中的空气再加热,且要在HCl气流中加热制备,反应结束后先熄灭酒精灯,继续通入氮气直至装置冷却,所以操作顺序为:a-c-d-b-e,故答案为c d b;
(3)B中物质由白色变为蓝色,说明有水生成,产物中还有Cl2,氯气与水反应生成盐酸和次氯酸,所以C中石蕊试纸先逐渐变为红色,后褪色,故答案为先变红,后褪色;
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为Cl2+2OH-=Cl-+ClO-+H2O;
(5)①根据题给信息知若杂质是CuCl2,说明CuCl2没有反应完全,原因为加热时间不足或温度偏低,故答案为:加热时间不足或温度偏低;
②若杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO,原因是通入HCl的量不足,故答案为:通入HCl的量不足或没有在HCl氛围中加热。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案