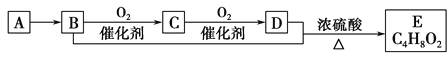
题目内容
【题目】某有机物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确的是
A. 该化合物仅含碳、氢两种元素
B. 该化合物中碳、氢原子个数比为1∶4
C. 无法确定该化合物是否含有氧元素
D. 该化合物中一定含有氧元素
【答案】BD
【解析】
化合物燃烧生成8.8gCO2和7.2gH2O,根据元素守恒则一定含有C、H元素,8.8g二氧化碳的物质的量为![]() =0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,7.2g水的物质的量为
=0.2mol,n(C)=n(CO2)=0.2mol,m(C)=0.2mol×12g/mol=2.4g,7.2g水的物质的量为![]() =0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,氧原子物质的量为
=0.4mol,n(H)=2n(H2O)=0.8mol,m(H)=0.8g,由于m(C)+m(H)=2.4g+0.8g=3.2g<6.4g,所以该化合物中一定含有氧元素,该化合物为烃的含氧衍生物,氧原子物质的量为![]() =0.2mol,故化合物中N(C):N(H):N(O)=0.2mol:0.8mol:0.2mol=1:4:1,该化合物中的最简式为:CH4O,由于H原子已经达到饱和,则其最简式即为其分子式,综上分析可知,AC错误,BD正确,故选BD。
=0.2mol,故化合物中N(C):N(H):N(O)=0.2mol:0.8mol:0.2mol=1:4:1,该化合物中的最简式为:CH4O,由于H原子已经达到饱和,则其最简式即为其分子式,综上分析可知,AC错误,BD正确,故选BD。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目