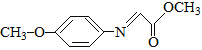
题目内容
【题目】已知烯烃在臭氧作用下,双键断裂如下:
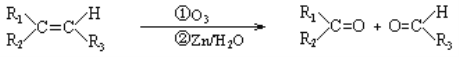
(1)判断下列有机物经臭氧化分解的产物
①![]() ______________________________________________________________
______________________________________________________________
②![]() _____________________________________________________________________
_____________________________________________________________________
③![]() ________________________________________________________
________________________________________________________
(2)如果二甲苯也能发生臭氧化分解,则判断邻二甲苯的臭氧化分解产物_______________________________
(3)若烯烃A(C8H16)经臭氧化分解后仅得一种化合物B,B经催化氢化后生成醇C(C4H10O),C用浓H2SO4处理后只生成一种无侧链的烯烃D(C4H8),则A的结构简式为__________________。
【答案】CH3COCH3OHC-CHO和OHCCH2CH2CHO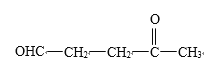 OHC-CHO,
OHC-CHO,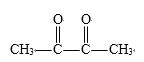 ,
, CH3CH2CH2CH=CHCH2CH2CH3
CH3CH2CH2CH=CHCH2CH2CH3
【解析】
(1)①根据信息,碳碳双键发生断裂,如果双键的碳原子上无H,则被氧化成酮,如果含有H,则被氧化成醛基,则该有机物经臭氧化分解的产物是CH3COCH3;②该有机物中含有两个碳碳双键,根据信息的分析,其产物是OHC-CHO和OHCCH2CH2CHO;③根据上述信息,以及该高分子化合物的连接,得出产物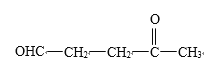 ;(2)
;(2)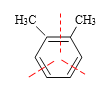 得到产物是
得到产物是 和OHC-CHO,
和OHC-CHO,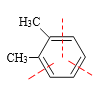 得到产物是OHC-CHO和
得到产物是OHC-CHO和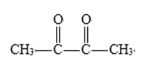 ;(3)D是无侧链的烯烃,D的结构简式是CH2=CHCH2CH3,C为醇,即C的结构简式为CH3CH2CH2CH2OH,B经催化氢化后生成C,则B的结构简式为CH3CH2CH2CHO,则烯烃A的结构简式为CH3CH2CH2CH=CHCH2CH2CH3。
;(3)D是无侧链的烯烃,D的结构简式是CH2=CHCH2CH3,C为醇,即C的结构简式为CH3CH2CH2CH2OH,B经催化氢化后生成C,则B的结构简式为CH3CH2CH2CHO,则烯烃A的结构简式为CH3CH2CH2CH=CHCH2CH2CH3。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】硫酰氯(SO2Cl2)和亚硫酰氯(SOCl2)常用作氯化剂,都可用于医药、农药、染料工业及有机合成工业。亚硫酰氯还用于制锂亚硫酰氯(Li/SOCl2)电池。
有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 具有吸水性且难分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g) ![]() SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:
SO2Cl2(l) △H= - 97.3 kJ·mol-1。反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A的名称为___________;
(2)仪器B的作用是_____________________;
(3)装置丙中盛放的试剂为____________,在实验室用氢氧化钠吸收多余硫酰氯反应的离子方程式为___________________;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的实验操作名称为__________________,
②设计实验方案检验氯磺酸分解制取硫酰氯产品中混有硫酸,下列方案合理的是:_____(填字母)
A.取样品溶于水,滴加紫色石蕊溶液变红:再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4。
B.取样品在干燥条件下加热至完全反应,冷却后直接加BaCl2溶液,有白色沉淀,再滴加紫色石蕊溶液变红,说明含有H2SO4。
(6)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解质溶液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2===4LiCl+S+SO2。
①写出该电池正极发生的电极反应式_______________________________
②组装该电池必须在无水、无氧的条件下进行,原因是__________________