题目内容
【题目】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4 及K、Br 等元素)的利用具有非常广阔的前景。
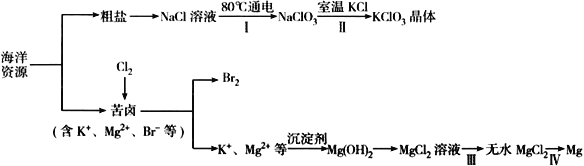
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Mg2+和Ca2+,要加入的试剂分别为__________________、__________________。
(2)写出步骤Ⅰ 中反应的总化学方程式为___________________________________。
(3)简述步骤Ⅱ中能析出KClO3 晶体而无其他晶体析出的原因是_____________________________。
(4)已知MgCl2 溶液受热时易水解生成Mg(OH)Cl,写出该过程的化学方程式__________________。
(5)为得到无水MgCl2,步骤Ⅲ的操作应为_____________________________。
(6)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_________
A.H2 B.N2 C. CO2 D.空气
(7)海水中溴含量为65mg·L-1。若1L 海水中95%溴元素被氧化为Br2 经热空气吹出,溴单质残留量3%。最后用SO2 将90%Br2 还原成Br-,所得溶液体积为50mL。此过程的目的为________________。所得溶液中溴离子浓度为海水中溴离子浓度的_____________倍(精确到0.1)。
【答案】 NaOH 溶液 Na2CO3溶液 NaCl+3H2O═NaClO3+3H2↑ 室温下 KClO3在水中的溶解度明显小于其它晶体 MgCl2+H2O![]() Mg(OH)Cl+HCl↑ 在干燥的 HCl 气流下加热 A 提高溴离子的浓度, 富集溴元素 16.6倍
Mg(OH)Cl+HCl↑ 在干燥的 HCl 气流下加热 A 提高溴离子的浓度, 富集溴元素 16.6倍
【解析】(1)食盐溶液中混有Mg2+ 和Ca2+,可以利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+,故答案为:NaOH溶液;Na2CO3溶液;
(2)步骤Ⅰ为电解氯化钠溶液生成氯酸钠的反应,反应的总化学方程式为NaCl+3H2O═NaClO3+3H2↑,故答案为:NaCl+3H2O═NaClO3+3H2↑;
(3)相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度明显小于其它晶体,所以先析出KClO3;故答案为:室温下,氯酸钾在水中的溶解度明显小于其他晶体;
(4)如果直接在空气中加热MgCl2则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;其反应方程式为:MgCl2+H2O ![]() Mg(OH)Cl+HCl↑,故答案为:MgCl2+H2O
Mg(OH)Cl+HCl↑,故答案为:MgCl2+H2O ![]() Mg(OH)Cl+HCl↑;
Mg(OH)Cl+HCl↑;
(5)如果直接在空气中加热MgCl2则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,故答案为:在干燥的 HCl 气流下加热;
(6)镁能与氧气反应生成氧化镁、与氮气反应生成氮化镁、与二氧化碳反应生成氧化镁和碳,与氢气不反应,故选A;
(7)海水中95%溴元素被氧化为Br2经热空气吹出,用SO2将90%Br2还原成Br-,经过这些操作后,溶液的溴离子的浓度增大,属于富集溴元素的过程;富集后的溴离子的质量为65mg×(95%-3%)×90%,因此所得溶液中溴离子浓度为海水中溴离子浓度的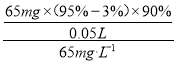 =16.6,故答案为:提高溴离子的浓度,富集溴元素;16.6。
=16.6,故答案为:提高溴离子的浓度,富集溴元素;16.6。

【题目】某小组同学利用下列实验探究金属铝与不同铜盐溶液的反应:
实验 | 实验方案 | 现象 |
1 | 向5mLlmol/LCuSO4溶液中加入用砂纸打磨过的铝片 | 铝片表面无明显现象,20min后铝片表面有极少气泡,且有很少量红色物质生成 |
2 | 向5mLlmol/LCuCl2溶液中加入用砂纸打磨过的铝片 | 铝片表面有气泡产生,同时有红色物质析出,1min后反应进一步加快,放出大量的热,有少量黑色固体生成。一段时间后烧杯底部出现白色沉淀 |
(1)打磨铝片的目的是_____________________________。
(2)实验中出现的红色物质是_______________________________。
(3)实验2中“1min后反应进一步加快”的原因是________________________________。
(4)经检验实验1、2中产生的无色气体是H2,黑色固体为CuO,试用离子方程式解释H2产生的原因__________________________,用文字简述黑色固体产生的原因____________________________。
(5)依据上述实验1、2现象推测并判断,用砂纸打磨后的铝片分别与H+浓度均为0.2molL-1的盐酸和硫酸反应,反应速率:前者比后者____________(填“快”或“慢”)
(6)经证明实验2 中白色沉淀的化学成分为CuCl。某同学猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有________性。依据猜测他进行了如下实验:取Cu粉与适量1mol/LCuCl2溶液混合,一段时间后观察无白色沉淀产生。该同学再次分析Al 与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,他的改进方法为__________________。

