题目内容
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g)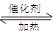 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
|
反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
|
0 |
1.20 |
1.60 |
|
2 |
0.90 |
|
|
4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)= ,4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2)700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.体系密度保持不变
d.每消耗1 mol NO2的同时生成2 mol H2O
(1)0.10mol/(L·min) C7(N2) ·C12(H2O)/ C6(NO2) ·C8(NH3) 75% (2) ab
【解析】
试题分析:由方程式可知反应物和生成物的反应计量数之和不相等所以压强不变时达到平衡状态;混合气体的颜色保持不变也表明达到平衡状态;因为反应物和生成物均为气体,气体的质量不变容器的体积不变所以体系的密度始终不变。
考点:化学反应速率、化学平衡常数及转化率、化学平衡状态的确定。

研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3,
反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3,
反应过程中测定的部分数据见下表
|
反应时间/min |
n(NO2)/mol |
n(NH3)/ mol |
|
0 |
1.20 |
1.60 |
|
2 |
0.90 |
|
|
4 |
|
0.40 |
(1)反应在2min内的平均速率为v(NH3)=
4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2) 700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系密度保持不变 d.每消耗1 mol NO2的同时生成2 mol H2O
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)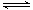 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将
移动(填向左,向右,不);CO的浓度将
(增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将
移动(填向左,向右,不);CO的浓度将
(增大,减小,不变)
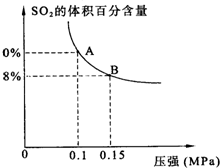 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.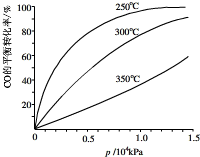 (2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义. 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.