题目内容
将pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为
| A.0.011 mol/L | B.0.22 mol/L | C.0.022 mol/L | D.0.11 mol/L |
A
解析试题分析:当向稀硫酸加入BaCl2溶液时发生反应:SO42-+ Ba2+==BaSO4↓,溶液中氢离子的物质的量与氯离子的物质的量相同。反应前稀硫酸溶液pH=1,反应后混合溶液的pH=2,溶液的体积为100ml., 混合时溶液体积的变化忽略不计,所以BaCl2的溶液的体积是硫酸体积的9倍,则硫酸溶液体积是10ml, BaCl2的溶液的体积是90ml。所以原BaCl2溶液中Cl-的浓度约为(0.01mol/L×0.1L)÷0.09L="0.011" mol/L.选项是A.
考点:考查酸碱混合溶液中微粒的关系的知识。

练习册系列答案
相关题目
能用离子方程式Ba2++SO42- →BaSO4↓表示的是
| A.氯化钡和硫酸钠溶液反应 | B.碳酸钡和稀硫酸反应 |
| C.氢氧化钡和硫酸铝溶液反应 | D.氢氧化钡和稀硫酸反应 |
下列离子方程式错误的是
| A.Fe(OH)2溶液中加入HNO3溶液:Fe(OH)2+2H+=2H2O+Fe2+ |
| B.盐酸除去铜器表面的铜绿:Cu2(OH)2CO3+4H+=3H2O+2Cu2++CO2↑ |
| C.氯气可以降低的SO2的漂白性:SO2+Cl2+2H2O=2Cl—+4H++SO42— |
| D.CO2通入饱和碳酸钠溶液:CO2+ CO32—+2Na++H2O=2NaHCO3↓ |
下列离子方程式正确的是
| A.用铜作电极电解CuSO4溶液:2Cu2++2H2O电解2Cu+4H++O2↑ |
| B.硅酸钠溶液与醋酸溶液混合:SiO32-+H+=H2SiO3↓ |
| C.H2O2溶液中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如下图,符合图中情况的一组物质是 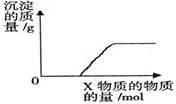
| | (A) | (B) | (C) | (D) |
| X | Ba(HCO3)2 溶液 | Na2CO3 溶液 | KOH 溶液 | CO2 气体 |
| Y | NaOH 溶液 | CaCl2 溶液 | Mg(HSO4)2 溶液 | 石灰水 |
下列表示对应化学反应的离子方程式正确的是
A.Na2CO3溶液的水解:CO32-+ H3O+ HCO3-+H2O HCO3-+H2O |
| B.钢铁吸氧腐蚀时,负极反应式为:4OH――4e-=2H2O+O2↑ |
| C.向Al2(SO4)3溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀: 2Al3++3 SO42-+8OH—+3Ba2+=2AlO2-+ 3BaSO4↓+4H2O |
| D.氯化亚铁溶液中滴入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
下列离子方程式中正确的是
| A.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
B.硫化钠的水解反应:S2-+H3O+ HS-+H2O HS-+H2O |
| C.1 mol/L的KAl(SO4) 2溶液与2 mol/L的Ba(OH) 2溶液等体积混合:Al3++4OH—= AlO2—+2H2O |
| D.用食醋溶解水垢:2H++CaCO3=Ca2++H2O+CO2↑ |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、 SO42- |
| B.滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C.由水电离出的C (H+)·C(OH-)=10-24溶液:K+、Na+、NO3-、Cl- |
| D.无色溶液:K+、 Al3+ 、ClO-、SO42- |
常温下,下列分子或离子在指定的条件中能大量共存的一组是
| A.在pH=l的溶液中:Na+、Fe2+、SO42—、Cl— |
| B.在碳酸钠溶液中:NO3—、CO2、K+、Br— |
| C.能使酚酞试液变红的溶液中:NH3·H2O、K+、Mg2+、ClO— |
| D.加入Al能放出氢气的溶液中:H+、Na+、SO42—、NO3— |