题目内容
【题目】在如图所示的量热计中,将100mL0.50mol/L CH3COOH溶液与100mL0.55mol/LNaOH溶液混合,温度从25.0℃升高到27.7℃。已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,两溶液的密度均近似为lg/mL.下列说法错误的是
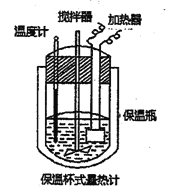
A. 若量热计的保温瓶绝热效果不好,则所测△H偏大
B. 该实验测得反应放出的热量为2665.7J
C. 该实验测得的中和热ΔH为-45.2kJ/mol
D. 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和
【答案】C
【解析】A. 若量热计的保温瓶绝热效果不好,则会损失一部分热量,则测出放出热量偏少,因为ΔH为负值,若量热计的保温瓶绝热效果不好,则所测△H偏大,故A正确;B.Q=cm△t=2.7×4.184J.g1.℃1×200g+150.5J.℃1×2.7℃=2665.71J 该实验测得反应放出的热量为2665.7J,故B正确;C. 温度从25.0℃升高到27.7℃,![]() ,
,![]() 的中和热
的中和热![]()
,故C错误; D. 酸和碱反应测中和热时,为了保证一方完全反应,往往需要另一方试剂稍稍过量,减少实验误差,所以加NaOH溶液过量的目的是保证CH3COOH溶液完全被中和,故D正确;故选C。

 小学课时特训系列答案
小学课时特训系列答案【题目】氨在国民生产中占有重要的地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
(1)反应进行到2小时时放出的热量为____________kJ。
(2)此条件下该反应的化学平衡常数K=____________(保留两位小数)。
(3)有两个密闭容器A和B,A容器保持恒容,B容器保持恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)![]() 3H2(g)+N2(g)。则:
3H2(g)+N2(g)。则:
①达到平衡所需的时间:t(A)_____t(B),平衡时,NH3的转化率:a(A)______a(B) (填“>”、“=”或“<”)。
②达到平衡后,在两容器中分别通入等量的氦气。A中平衡向_________移动,B中平衡向_________移动。(填“向正反应方向”、“向逆反应方向”、“不”)。
(4)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[φ(NH3)]随时间变化的曲线图所示.下列说法中正确的是_____(填字母,下同)。
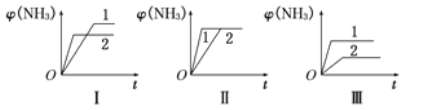
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2