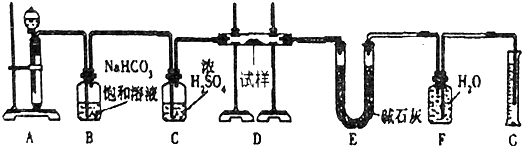
题目内容
1.某样品是由碳酸钠与氯化钠组成的固体混合物,现欲测定样品中碳酸钠的质量分数.某同学称取10.00g样品.配成1000mL溶液.用碱式滴定管(填仪器名称)量取25.00mL放入锥形瓶中.加入甲基橙作指示剂.用0.1500mol•L-1标准盐酸滴定至终点.平行测定三次.有关实验数据记录如表,则样品中碳酸钠的质量分数为95.4%.
| 试验编号 | 待测液体积(mL) | 标准液体积(mL) | |
| 滴定前读数 | 终点时读数 | ||
| 1 | 25.00 | 0.00 | 30.02 |
| 2 | 25.00 | 0.20 | 33.80 |
| 3 | 25.00 | 1.40 | 31.38 |
分析 混合溶液呈碱性,由量取溶液体积精确度可知,可以用碱式滴定管量取25.00mL溶液;
第2次消耗标准液体积与第1次、第3次消耗标准液体积相差较大,应舍弃第2次实验,第1次、第3次消耗标准液的平均值为消耗的标准液体积,由于加入甲基橙作指示剂,反应后溶液为酸性,故发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据n=cV计算消耗HCl物质的量,再根据方程式计算Na2CO3的物质的量,可以计算1000mL溶液中Na2CO3的物质的量,根据m=nM计算Na2CO3的质量,进而计算样品中Na2CO3的质量分数.
解答 解:混合溶液呈碱性,由量取溶液体积精确度可知,可以用碱式滴定管量取25.00mL溶液;
第1次消耗盐酸体积为:30.02mL-0.00mL=30.02mL,
第2次消耗盐酸体积为:33.80mL-0.20mL=36.60mL,
第3次消耗盐酸体积为:31.38mL-1.40mL=29.98mL,
由于第2次消耗标准液体积与第1次、第3次消耗标准液体积相差较大,应舍弃第2次实验,故消耗盐酸的体积为$\frac{30.02mL+29.08mL}{2}$=30mL,
由于加入甲基橙作指示剂,反应后溶液为酸性,故发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,则25.00mL溶液中n(Na2CO3)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.03L×0.1500mol/L,故1000mL溶液中n(Na2CO3)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.03L×0.1500mol/L×$\frac{1000}{25}$=0.09mol,m(Na2CO3)=0.09mol×106g/mol=9.54g,样品中Na2CO3的质量分数为$\frac{9.54g}{10.00g}$×100%=95.4%,
故答案为:碱式滴定管;95.4%.
点评 本题考查滴定应用与计算等,关键是对实验数据的分析处理,能很好地训练学生的思维能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案(1)下列措施中,有利于降低大气中CO2浓度的有abc.(填字母编号)
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇的热化学方程式是:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol.
(3)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| 温度(k) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比,CO2的转化率增大(填“增大”“减小”或“不变”).
②该反应的正反应为放(填“吸”或“放”)热反应.
③在图一的坐标系中作图,说明压强由p1增大到p2时,由于平衡移动引起H2转化率和乙醇百分含量的变化.

| A. | 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2 | |
| B. | 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2 | |
| C. | 由Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 所以Cu+I2$\frac{\underline{\;\;△\;\;}}{\;}$CuI2 | |
| D. | 由钠保存在煤油中,所以钾也可以保存在煤油中 |
| A. | 1mol Na2O2与水反应,转移电子1mol | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| C. | 钠能与氧气和水反应,钠暴露在空气中最终的产物是NaOH | |
| D. | 将0.01mol的Na2O和Na2O2分别投入同质量的水中,所得到的溶质质量分数不同 |
| A. | 分子半径 | B. | 分子质量 | ||
| C. | 分子总数 | D. | 分子间的平均距离 |
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: