题目内容
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答:
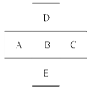
(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
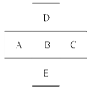
(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
(每空1分,共7分) (1)P S Cl O (2) Cl<S<P
(3) HClO4>H2SO4>H3PO4 (4)H2O>H2S
(3) HClO4>H2SO4>H3PO4 (4)H2O>H2S
A元素的最低化合价为-3价,则最高价氧化物是A2O5,所以有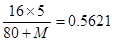 ,解得M=31。又因为A原子核内中子数比质子数多1,所以A的质子数是15,即为P,则B、C、D、E分别是S、Cl、O、Se。
,解得M=31。又因为A原子核内中子数比质子数多1,所以A的质子数是15,即为P,则B、C、D、E分别是S、Cl、O、Se。
(2)同周期自左向右原子半径逐渐减小,所以顺序是Cl<S<P。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,同周期自左向右非金属性逐渐增强,所以是HClO4>H2SO4>H3PO4。同主族自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,即H2O>H2S。
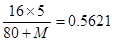 ,解得M=31。又因为A原子核内中子数比质子数多1,所以A的质子数是15,即为P,则B、C、D、E分别是S、Cl、O、Se。
,解得M=31。又因为A原子核内中子数比质子数多1,所以A的质子数是15,即为P,则B、C、D、E分别是S、Cl、O、Se。(2)同周期自左向右原子半径逐渐减小,所以顺序是Cl<S<P。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,同周期自左向右非金属性逐渐增强,所以是HClO4>H2SO4>H3PO4。同主族自上而下非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,即H2O>H2S。

练习册系列答案
相关题目


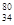 Se。下列有关该同位素的说法正确的是( )
Se。下列有关该同位素的说法正确的是( )