题目内容
3.W、X、Y、Z是短周期元素,其部分性质如表:| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的2323 |
| Z | 第3周期原子半径最小的金属 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 非金属性:Y<W;离子半径:Z>W | |
| C. | W在空气中燃烧所得产物,可用于杀菌消毒 | |
| D. | 金属Z与少量NaOH溶液反应,生成两性氢氧化物 |
分析 W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的23,只能处于第二周期,令最外层电子数为x,则23(2+x)=x,解得x=4,则Y为C元素;Z是第3周期原子半径最小的金属,则Z为Al,结合元素周期律与元素化合物性质解答.
解答 解:W、X、Y、Z是短周期元素,W单质是淡黄色固体,则W为S元素;X在地壳中的含量居第二位,则X为Si;Y原子最外层电子数是电子总数的23,只能处于第二周期,令最外层电子数为x,则23(2+x)=x,解得x=4,则Y为C元素;Z是第3周期原子半径最小的金属,则Z为Al.
A.非金属性W(S)>X(Si),故硫化氢更稳定性,故A错误;
B.非金属性:Y(C)<W(S),Al3+离子比S2-离子少一个电子层,则离子半径Al3+<S2-,故B错误;
C.W在空气中燃烧所得产物为二氧化硫,可用于杀菌消毒,故C正确;
D.铝与氢氧化钠溶液反应生成偏铝酸钠,故D错误,
故选:C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
4.下列叙述正确的是( )
| A. | 摩尔是国际单位制的7个基本物理量之一 | |
| B. | 物质的量可以理解为物质的质量 | |
| C. | 物质的量的单位是“摩尔” | |
| D. | 物质的量是表示物质的数量的单位 |
14. 一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
 一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )
一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)△H,经过一段时间后达到平衡,反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在50s~250s内的平均速率v(PCl3)=4.0×10-4mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl5)=0.38 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,将容器的容积缩小一半,平衡逆向移动,化学平衡常数减小 | |
| D. | 相同温度下,起始时向容器中充入0.5 mol PCl5,重新达到平衡时,0.1 mol<n(PCl3)<0.2 mol |
18.下列说法正确的是( )
| A. | 铝与氧气在常温下不反应 | |
| B. | 铝的化学性质不活泼 | |
| C. | 常温下与氧气反应,铝的表面形成了一层致密的氧化膜 | |
| D. | 铝制容器既耐酸又耐碱 |
8.用水稀释0.1mol•L-1氨水,溶液中随着水量的增加而增大的是( )
| A. | c(H+)•c(NH3•H2O)c(NH+4) | B. | c(NH+4)•c(OH−)c(NH3•H2O) | ||
| C. | cH+cOH− | D. | c(H+)•c(OH-) |
15.下列叙述正确的是( )
| A. | 一氧化碳的摩尔质量为28g | |
| B. | 0.5 mol OH-的质量为8.5g | |
| C. | 镁原子的摩尔质量等于它的相对原子质量 | |
| D. | 一个钠原子的质量等于236.02×1023 |
13.下列与含氯物质有关的说法正确的是( )
| A. | 氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| D. | 电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) |
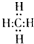 ,结构式是
,结构式是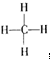 ,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)
,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)