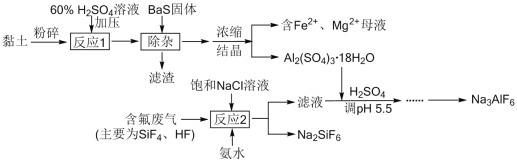
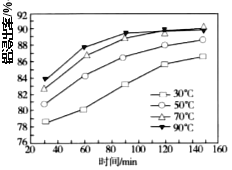
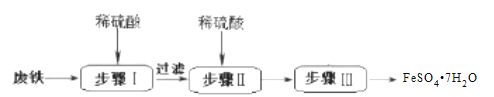
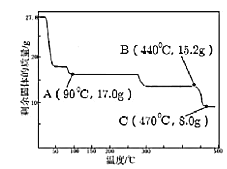
题目内容
【题目】A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne 具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)C元素位于第______周期第_____族,它的最高价氧化物的化学式为____。
(2)A元素是_____,B元素是_____,D元素是_____。(填元素符号)
(3)A与D形成稳定化合物的化学式是______,该化合物中存在的化学键类型为___,判断该化合物在空气中是否变质的简单方法是______。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______。
【答案】三 ⅦA Cl2O7 Na Mg O Na2O2 离子键和(非极性)共价键 看表面颜色是否变白 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;5.8 g B的氢氧化物恰好能与100 mL2 mol/L盐酸完全反应,n(H+)=n(OH-),设B的化合价为x,摩尔质量为y,则![]() ×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6符合,即D为O元素,然后利用元素及其单质、化合物的性质来解答。
×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6符合,即D为O元素,然后利用元素及其单质、化合物的性质来解答。
根据上述分析可知A是Na,B是Mg,C是Cl,D是O元素。
(1)C是Cl元素,Cl原子核外电子排布为2、8、7,根据原子核外电子排布与元素位置的关系可知:Cl位于元素周期表第三周期第ⅦA族,Cl最外层有7个电子,最高化合价为+7价,其最高价氧化物为Cl2O7;
(2)根据以上分析可知A是Na元素,B是Mg元素,D是O元素;
(3)A、D两种元素形成的稳定氧化物是Na2O2,该物质属于离子晶体,含有离子键和非极性共价键。过氧化钠为淡黄色,Na2O2容易与空气中的CO2、H2O发生反应,若变质,最终会变为白色的Na2CO3,所以判断该化合物在空气中是否变质的简单方法是看表面颜色是否变白;
(4)C是Cl元素,其单质Cl2是有毒气体,可根据Cl2能够与NaOH溶液反应的性质除去,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆